Реакция азосочетания.
Взаимодействие ароматических солей диазония с фенолами или ароматическими аминами, приводящее к образованию азосоединений, называется азосочетанием.
Катионы арилдиазония являются слабыми электрофилами и причиной тому является делокализация положительного заряда вследствие сопряжения с ароматическим ядром.
Несмотря на это катион диазония способен взаимодействовать с производными бензола и/или нафталина, содержащими такие сильные электронодонорные заместители как ОН, NH2, NHR1, NR1R2, O–, OR.
Реакционная способность самой соли диазония также существенно зависит от природы заместителей в бензольном ядре: электрофильные свойства катиона усиливаются под влиянием электроноакцепторных заместителей, и уменьшаются в присутствии электронодонорных заместителей.
В отличие от других реакций, протекающих по механизму электрофильного замещения в ароматическом ядре, азосочетание характеризуется очень высокой избирательностью: с фенолами и аминами реакция протекает преимущественно по пара-положению к гидрокси- или аминогруппе (доля продукта по орто-положению составляет 1-2%). Если же пара-положение занято, то замещение идёт по орто-положению.
В реакции азосочетания соль диазония принято называть диазосоставляющим компонентом, а фенол или амин – азосоставляющим.
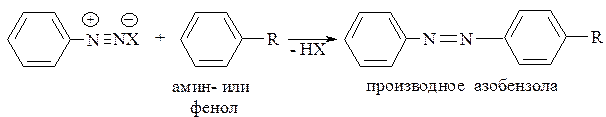
Выбор условий реакции азосочетания зависит от природы заместителей в азосоставляющем компоненте.
Для сочетания с аминами в качестве азокомпонента следует поддерживать слабокислую среду, ибо в нейтральной или слабощелочной средах амин выделяется в виде осадка, а среда становиться гетерогенной. Кроме этого по аминогруппе азосоставляющего компонента возможна побочная реакция – образование триазена (см. выше).

 В сильнокислой среде аминогруппа протонируется, вследствие чего в образовавшейся соли группа является сильным электроноакцептором, дезактивирующим бензольное ядро. Азосочетание в таком случае будет проходить очень медленно, по мере того, как соль амина будет гидролизоваться до основания амина.
В сильнокислой среде аминогруппа протонируется, вследствие чего в образовавшейся соли группа является сильным электроноакцептором, дезактивирующим бензольное ядро. Азосочетание в таком случае будет проходить очень медленно, по мере того, как соль амина будет гидролизоваться до основания амина.
Ароматические амины, содержащие электроноакцепторные заместители – мета-нитроанилин, мета-хлоранилин, мета-аминобензолсульфокислота и ряд других, в реакцию азосочетания не вступают.
В сильнощелочной среде соль диазония переходит в диазотат, который не является электрофилом и не может вступать в реакцию азосочетания:
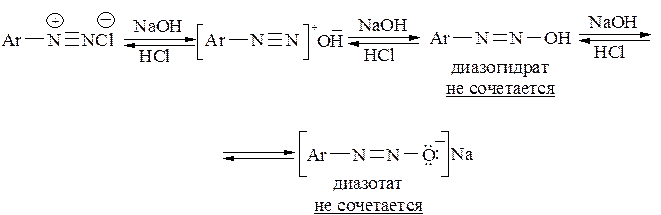
Азосочетание с участием фенолов следует проводить в слабощелочной среде: образующийся фенолят-анион значительно активнее вступает в реакции электрофильного замещения.
Если в орто- или пара-положениях к фенольному гидроксилу находятся сильные электроноакцепторные заместители, например, нитрогруппа, то такие нитрофенолы в реакцию азосочетания не вступают.
Салициловая же кислота, наоборот, вступает в азосочетание, так как карбоксигруппа является более слабым электроноакцептором.
В случае пара-аминофенола имеет место несогласованная ориентация заместителей, но, изменяя рН-среды, азосочетание можно проводить избирательно по орто-положению к ОН-группе, либо NH2-группе:
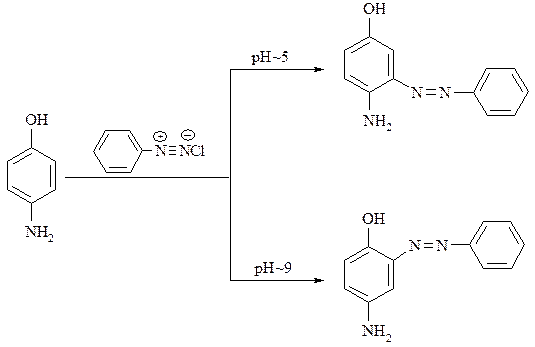
Механизм азосочетания. Реакция азосочетания протекает по обычному электрофильному механизму: вначале образуется π-комплекс азосоставляющего компонента с электрофилом (диазокомпонентом).
Далее π-комплекс переходит в σ-комплекс, который обладает более сильной кислотностью, чем катион диазония, в связи с чем легко депротонируется с образованием азосоединения:
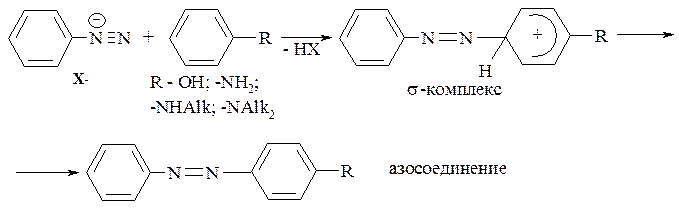
Азосоединения
Азосоединения – это соединения, в которых азогруппа связана с двумя углеводородными радикалами:
В азогруппе атомы азота находятся в состоянии sp2-гибридизации и содержат неподелённые пары элктронов, располагающихся на гибридных орбиталях.
Будучи сопряженными системами, азобензол и другие азоарены могут существовать в виде π-диастереомеров (цис- и транс-изомеров):
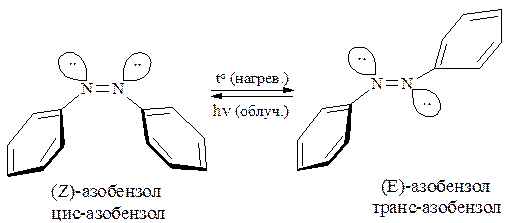
Более стабильным является транс-изомер, в котором сопряжение максимальное.
При ультрафиолетовом облучении транс-изомер переходит в менее устойчивый цис-изомер, время жизни которого незначительна. При нагревании цис-изомер вновь переходит в транс-.
Дата добавления: 2020-10-01; просмотров: 1542;











