Физические свойства
В обычных условиях метантиол – газ, а его гомологи представляют собой жидкости, кипящие при температурах выше 35оС. Все тиолы и сульфиды характеризуются неприятным запахом. Тиолы и сульфиды плохо растворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства
Сера как элемент подгруппы кислорода является его электронным аналогом. Валентный угол в воде составляет 104,5о, а валентный угол в сероводороде составляет 92,2о. В спиртах валентный угол С–О–Н равен примерно ~109о, а в тиолах валентный угол С–S–H составляет 100 – 104о. Энергия связей Н–О 460 кДж/моль, а С–ОН 344кДж/моль. Энергия связей S–H и C–SH соответственно равны 339 кДж/моль и 260 кДж/моль. Полярность связи S–H значительно ниже, чем связи O–H. По сравнению со спиртами тиолы являются более сильными электронодонорами; межмолекулярные водородные связи у тиолов слабее, поэтому у них температуры кипения ниже, чем у спиртов.
Кислотные свойства
Кислотные свойства тиолов обусловлены ионизацией связи S–H. По сравнению со спиртами тиолы являются значительно более сильными кислотами и это объясняется особенностью строения тиолят-аниона, в котором отрицательный заряд делокализован в большей степени, чем в алкоголят-анионе.
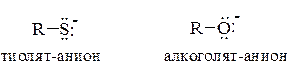
При взаимодействии с щелочами они образуют растворимые в воде тиоляты:
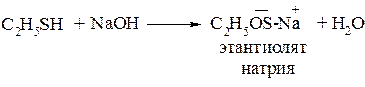
С катионами тяжелых металлов тиолы образуют нерастворимые тиоляты, которые, по сути, представляют собой соли ковалентного характера. С точки зрения принципа ЖМКО Пирсона тиолят-анион является «мягким» основанием, а катион ртути (II) – мягкой кислотой:
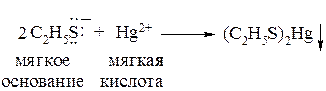
Дата добавления: 2020-10-01; просмотров: 707;











