Направление окислительно-восстановительных реакций
Возможность предсказать направление окислительно-восстановительной реакции представляет второй закон термодинамики. Если энергия Гиббса окислительно-восстановительной реакции ниже нуля (DG<0), то реакция может протекать в прямом направлении. Если указанная энергия выше нуля (DG>0), то прямая реакция в данных условиях невозможна, а возможна лишь обратная реакция. Энергию Гиббса реакции можно рассчитать, зная энергии Гиббса реакций образования продуктов и исходных веществ, которые для стандартных состояний приводятся в справочниках.
Пример: C-4H4+1(r) + CO2(r) « 2С+2O(r) + 2H20(r)
Энергия Гиббса данной реакции при стандартных состояниях 298К равна +170,63 кДж. Так как DG>0, то возможно протекание в этих условиях только обратной реакции.
7.2 Понятие об электродных потенциалах. Зависимость величины электродных потенциалов от различных факторов. Уравнение Нернста.
Если металлическую пластинку опустить в воду, то катионы металла на его поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся на металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие:
Me + mH2O « Me n+ ∙m H2O + ne
в растворе на металле
где n – число электронов, принимающих участие в процессе.
На границе металл-жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала – электродным потенциалом.
Абсолютные значения электродных потенциалов измерить не удается. Поэтому обычно определяют относительные электродные потенциалы в определенных условиях, так называемые стандартные электродные потенциалы (Е0).
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор, в котором концентрация (или активность) собственных ионов равна 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е0=0; DG=0).
Стандартный водородный электрод состоит из стеклянного сосуда, заполненного 2Н раствором H2SO4, в котором активность ионов Н+ равна единице. В этот раствор погружен электрод из платины, покрытый платиновой чернью для увеличения поверхности.


При использовании водородного электрода через раствор H2SO4 пропускают химически чистый водород. Боковая трубка с краном также заполнена раствором серной кислоты и служит для соединения водородного электрода с другим электродом. При контакте пластины с молекулярным водородом происходит адсорбция водорода на пластине. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в пластине электроны.
При этом пластина заряжается отрицательно, а раствор положительно. Возникает скачек потенциала между пластиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на электродном водороде можно представить в виде:
2Н+ + 2е → Н2
Определив стандартные потенциалы металлов относительно водородного электрода, располагаем их в ряд по мере возрастания алгебраической величины стандартный электродных потенциалов [E0], получаем ряд напряжений. Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов.
Чем дальше расположен металл в ряду напряжений, т. е. чем больше его стандартный потенциал, тем более сильным окислителем в водном растворе являются его ионы (и тем легче они принимают электроны), и наоборот, чем ближе металл к началу ряда, т. е. чем меньше значение Е0, тем более сильные восстановительные свойства проявляет простое вещество – металл (и тем легче он электроны отдает).
При изменение ряда параметров, например, концентрации или температуры, величину электродного потенциала на поверхности металла можно рассчитать по уравнению Нернста:
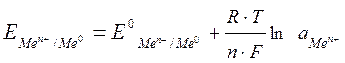 ,
,
где 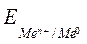 – электродный потенциал;
– электродный потенциал;
 – стандартный электродный потенциал;
– стандартный электродный потенциал;
R – газовая постоянная;
Т – температура;
F – число Фарадея;
n – число электронов, участвующих в электронной реакции;
а – активная концентрация ионов металла в растворе.
Потенциал электрода, как видно из этого уравнения, зависит от активности (концентрации) ионов металла, которые являются потенциалопределяющими, от природы электролита, от природы электрода, от заряда иона и от температуры.
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, а так же заменив активность на молярную концентрацию, получим удобную для расчетов форму уравнения Нернста:
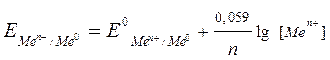 .
.
7.3 Гальванические элементы. ЭДС и ее измерение.
В рассмотренных выше окислительно-восстановительных реакциях переход электронов от восстановителя – атома активного металла – к окислителю – ионам неактивного металла – происходит непосредственно, поскольку восстановитель соприкасается с окислителем. Обе стадии реакции – окисление активного металла и восстановление неактивного металла пространственно не разделены, т. е. протекают в одном месте – месте соприкосновения активного металла с раствором соли другого металла.
Так, при опускании цинковой пластинки в раствор сульфата меди происходит реакция:
Zn + CuSO4 → ZnSO4 + Cu.
или в ионной форме: Zn0 + Cu2+ → Zn2+ + Cu0.
Здесь восстановитель – цинк – отдает электроны. Эта полуреакция выражается уравнением: Zn0 – 2ē → Zn2+.
Окислитель – ион меди – принимает электроны. Уравнение этой полуреакции имеет вид: Cu2+ + 2ē → Cu0.
Можно, однако, осуществить эту реакцию таким способом, что окислительная и восстановительная полуреакции окажутся пространственно разделенными, а электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока – по внешней цепи. Этот направленный поток электронов представляет собою электрический ток. Устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами.
В простейшем случае гальванический элемент состоит из двух пластин или стержней (электродов первого рода), изготовленных из различных металлов (окислительно-восстановительных пар), погруженных в раствор электролита (чаще – это раствор соли металла). Например, металлический электрод – металл, погруженный в раствор своей соли Mе/Mеn+.
Электрод, на котором происходит процесс окисления (анодный процесс), называется анодом. Роль анода играет металл с меньшей алгебраической величиной электродного потенциала, т. е. более активный металл. Электрод, на котором осуществляется восстановление (катодный процесс), называется катодом (металл с большей алгебраической величиной электродного потенциала).
Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление – на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи.
Рассмотрим в качестве примера медно-цинковый гальванический элемент (элемент Якоби-Даниэля), образованный двумя электродами первого рода и работающий за счет энергии приведенной выше реакции между цинком и раствором сульфатом меди.
Этот элемент состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора или соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала , или не соприкасаются, но взаимосвязь между ними осуществляется посредством проводника второго рода (электролитного мостика.
 а) б)
а) б)
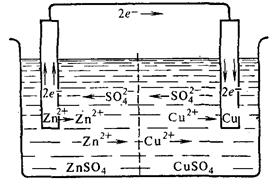
Схема гальванического элемента Якоби-Даниэля.
а) с растворами, соприкасающимися друг с другом;
б) с изолированными растворами
Работа гальванического элемента при замыкании цепи начинается с того, что электрод, изготовленный из более активного металла, в данном случае из цинка, взаимодействует с полярными молекулами воды, находящимися в соприкасающемся с поверхностью электрода растворе, по уравнению:
Zn0 + п Н2О → Zn2+∙ п Н2О + 2ē
или в упрощенной форме Zn0 – 2ē → Zn2+.
Образовавшиеся гидратированные катионы цинка переходят в раствор, а электроны заряжают отрицательно поверхность электрода. Электрод, на котором этот процесс происходит, получил название анода.Как видно, в данном случае анод заряжается отрицательно.
Осуществляется отвод высвобождающихся при этом электронов по внешней цепи с анода на катод в результате соединения цинкового электрода проволокой с медным электродом.
На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися катионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид:
Cu 2+∙ п Н2О + 2ē → Cu0 + п Н2О
или в упрощенной форме Cu2+ + 2ē → Cu0.
Таким образом, на медном электроде идет процесс восстановления меди, в связи с чем электрод, на котором этот процесс происходит, получил название катода. Число электронов, посылаемых в единицу времени анодом, равно числу электронов, проходящих в единицу времени через сечение проводника, и числу электронов, разряжающих в единицу времени катионы на катоде.
Суммарное уравнение реакции, протекающей в элементе (токообразующей реакции), получится при сложении уравнений обеих полуреакций:
Zn0 + Cu2+ → Zn2+ + Cu0
или в молекулярной форме:
Zn + CuSO4 → ZnSO4 + Cu
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи (проводнику первого рода), на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
У цинкового электрода катионы выходят в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор, наоборот, все время обедняется катионами, так что здесь раствор заряжается отрицательно. В результате этого создается электрическое поле, в котором катионы, находящиеся в растворе (Сu2+ и Zn2+), движутся от цинкового электрода к медному, а анионы SO42– – в обратном направлении. Движение ионов SO42– в растворе замыкает электрическую цепь гальванического элемента (например, если убрать электролитный мостик, то электрический ток по внешнему проводнику протекать не будет).
Таким образом, при замыкании внешней цепи, т. е. при соединении цинка с медью металлическим проводником, возникают самопроизвольные процессы растворения цинка (как более активного металла) на аноде и выделения меди (как менее активного металла) из раствора на катоде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не восстановится на медном электроде вся медь).
При схематическом изображении гальванического элемента граница раздела фаз между металлом и раствором обозначается одной вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой, которая отделяет анодное пространство от катодного. Слева записывается анод Zn¦Zn2+, на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс (–). Справа – катод Cu2+¦Cu – электрод с недостатком электронов, положительный полюс (+). Стрелками показано направление движения электронов во внешней цепи гальванического элемента.
Например, схема гальванического элемента Якоби-Даниэля изображается следующим образом (молекулярная форма):
2ē
 Zn ô ZnSO4 ôô CuSO4 ô Cu.
Zn ô ZnSO4 ôô CuSO4 ô Cu.
|
Эта же схема может быть изображена в ионной форме:
2ē
 Zn ô Zn2+ ôô Cu2+ ô Cu.
Zn ô Zn2+ ôô Cu2+ ô Cu.
|
Поскольку число электронов, которые за единицу времени отдает анод (цинк), равно числу электронов, принимаемых за это же время ионами катода (меди), скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного по цепи в единицу времени, т. е. силе тока в цепи.
Получаемая в процессе работы гальванического элемента энергия электрического тока равна произведению количества электричества, прошедшего от анода к катоду, на напряжение. Максимальное значение этого напряжения называется электродвижущей силой гальванического элемента.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором электродвижущая сила (ЭДС) элемента имеет положительное значение. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).
ЭДС гальванического элемента определяется как разность электродных потенциалов катода и анода:
ЭДС = ЕК – ЕА. .
В случае элемента Якоби-Даниэля (–)Zn¦Zn2+||Cu2+¦Cu(+) для стандартных условий:
ЭДС = Е0Cu – Е0Zn = 0, 34 – (–0, 76) = 1,1 В
Для нестандартных условий ЭДС элемента Якоби-Даниэля находится из разности электродных потенциалов, вычисленных по уравнению Нернста.
ГЭ может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией. Такие ГЭ называются концентрационными ГЭ. При этом электрод, помещенный в более разбавленный раствор, играет роль анода, а электрод в более концентрированном растворе — роль катода.
Электролиз.
Электролиз — физико-химическое явление, состоящее в выделении на электродах составных частей растворенных веществ или других веществ, являющихся результатом вторичных реакций на электродах, которое возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами – проводниками, соединенными с полюсами источника электрической энергии. Анодом называется положительный электрод, катодом – отрицательный. Положительные ионы – катионы – (ионы металлов, водородные ионы, ионы аммония и др.) – движутся к катоду, отрицательные ионы – анионы – ионы кислотных остатков и гидроксильной группы – движутся к аноду.
Этот окислительно-восстановительный процесс протекает на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов. На отрицательно заряженном электроде – катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде – аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).
В зависимости от того, какие вещества подвергаются электролизу, различают электролиз расплава (присутствует только вещество) и раствора (присутствует и вещество, и вода, которая в ряде случаев может вмешиваться в процесс электролиза).
Для протекания электролиза необходимо использовать токопроводящие электроды. Так как металл катода уже является восстановленной формой, то материал катода не оказывает значительного влияния на продукты реакций. Но материал анода сам может подвергнуться окислению в процессе электролиза. Поэтому различают электролиз с инертным или нерастворимым анодом (графитовым, угольным, платиновым и золотым) и с неинертным или растворимым анодом (изготовленным из любого металла, кроме платины и золота). В процессе электролиза такой анод всегда окисляется и разрушается.
Примеры электролиза расплавов с инертным анодом:

Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды):

Примеры электролиза растворов с инертным анодом:
При электролизе водных растворов следует учитывать, что на катоде в первую очередь восстанавливается та система, электродный потенциал которой имеет максимальное значение.
1. В первую очередь восстанавливаются металлы, имеющие положительную величину электродного потенциала (стоящие в ряду напряжения (СЭП) после водорода):
Меn+ + n ē → Ме0
2. В том случае, если значение стандартного электродного потенциала металла имеет промежуточное значение между – 0,41 В и 0 В в нейтральной среде (он занимает промежуточное положение между алюминием и водородом в ряду напряжения), то на катоде протекает преимущественно восстановление металла с незначительным выделение водорода из воды:
Меn+ + n ē → Ме0;
2Н2О + 2ē → Н2 + 2ОН−
3. Металлы, имеющие величину электродного потенциала меньше, чем – 0,41 В (стоят в ряду напряжения до алюминия, включая алюминий), из нейтральных растворов не восстанавливаются, а восстанавливается преимущественно водород из воды:
2Н2О + 2ē → Н2↑ + 2ОН−
Меn+ + n ОН− → Ме(ОН)n
В этом случае образуется гидроксид металла.
При записи анодных процессов необходимо учитывать, что на аноде в первую очередь окисляется та система, электродный потенциал которой имеет минимальное значение.
1. В первую очередь окисляется материал анода, если анод металлический:
Ме0 – n ē → Ме n+
2. На аноде протекает окисление кислотного остатка (аниона) в том случае, если значение его электродного потенциала имеет более отрицательное значение, чем потенциала окисления кислорода из воды) Поэтому, кислотный остаток окисляется только в том случае, если он не содержит кислород: Cl−, Br−, I−.
2Cl− – 2 ē → Cl2↑
3. В случае присутствия в растворе кислородосодержащего аниона (кислотного остатка), например, NO3−, SO42−, РО43− и т.д., на аноде протекает преимущественное окисление кислорода из воды:
2Н2О – 4ē → О2↑ + 4Н+
В этом случае образуется какая либо кислота.
Примеры электролиза растворов солей:
1. При электролизе раствора AgNO3 на электродах будут протекать следующие процессы:
К) Ag+ + 1е = Ag0
Серебро восстанавливается на катоде, поскольку стоит в ряду СЭП после водорода и обладает большей тенденцией к присоединению электронов по сравнению с ионами Н+.
А) 2Н2О –4е = О2 + 4Н+
2. При электролизе раствора CuCl2 на электродах будут протекать следующие процессы:
К) Cu2+ + 2е = Cu0
Медь восстанавливается на катоде, поскольку стоит в ряду СЭП после водорода и обладает большей тенденцией к присоединению электронов по сравнению с ионами Н+.
А) 2Cl– –2е = Cl2
Эта реакция окисления хлора протекает на аноде, так как электролизу подвергается водный раствор соли безкислородной кислоты.
3. При электролизе раствора КОН на электродах будут протекать следующие процессы:
К) 2Н2О + 2е = Н2 + 2ОН–
Сам калий на катоде восстанавливаться не будет, поскольку стоит в ряду СЭП до алюминия и обладает весьма слабой тенденцией к присоединению электронов, уступая в этом отношении ионам Н+.
А) 4ОН– –4е = О2 + 2Н2О
Эта реакция окисления кислорода протекает на аноде, так как электролизу подвергается водный раствор щёлочи.
4. При электролизе раствора CuSO4 на электродах будут протекать следующие процессы: К) Cu2+ + 2е = Cu0
Медь восстанавливается на катоде, поскольку стоит в ряду СЭП после водорода и обладает большей тенденцией к присоединению электронов по сравнению с ионами Н+.
В случае медного анода на нём будет протекать процесс окисления самого металла:
А) Cu0 – 2е = Cu2+
В случае угольного (инертного) анода на нём будет протекать процесс электрохимического окисления воды с выделением кислорода, поскольку электролизу подвергается водный раствор соли кислородосодержащей кислоты.
А) 2Н2О –4е = О2 + 4Н+
2Н+ + SO42– = Н2SO4
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения водорода, а также гидроксида натрия, хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование).
Электролиз находит применение для очистки сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
7.5 Законы Фарадея, выход по току.
В 1832 году Фарадей установил, что масса (объем) вещества, выделившегося или разложившегося на электроде, прямо пропорциональна электрическому заряду Q, прошедшему через электролит (первый закон Фарадея):
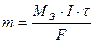 или
или 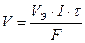 ,
,
где m (V) – масса (объем) вещества, окисленного или восстановленного при электролизе;
МЭ (VЭ) – молярная масса (объем) эквивалента этого вещества;
I – сила тока, А;
τ – продолжительность электролиза, с;
F – число Фарадея, равное 96500 Кл;
Второй закон Фарадея:
При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств веществ:
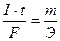 или
или 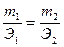 .
.
В процессе электролиза часть электричества может расходоваться на протекание каких-либо побочных процессов, поэтому масса или объем вещества может оказаться меньше расчетной величины. Поэтому вводят такое понятие, как выход вещества по току:
 или
или 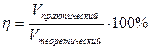
7.6 Коррозия и защита металлов и сплавов. Основные виды коррозии.
Коррозия металлов – самопроизвольное разрушение металлов и изделий из них вследствие физико-химического воздействия внешней среды, при котором металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства.
Общая масса металлических материалов, используемых в виде различных изделий в мировом хозяйстве, очень велика. Поэтому, несмотря на то, что обычно скорость коррозии мала, ежегодно из-за коррозии безвозвратно теряются огромные количества металла. По ориентировочным подсчетам безвозвратные потери металла от коррозии составляют 10–15 % мировой продукции стали. Но еще больший вред связан не с потерей металла, а с порчей изделий, вызываемой коррозией.
В основе коррозийных процессов лежат окислительно-восстановительные реакции металлов с окружающей средой, сопровождающиеся переходом металлов в более термодинамически устойчивое состояние.
Среда, в которой металл подвергается коррозии (коррозирует) называется коррозионной или агрессивной средой. В зависимости от уровня рН выделяют коррозию в трех средах: кислой, щелочной и нейтральной.
Скорость коррозии металлов и металлических покрытий в атмосферных условиях определяется комплексным воздействием ряда факторов: наличием на поверхности фазовых и адсорбционных пленок влаги, загрязненностью воздуха коррозионно-агрессивными веществами, изменением температуры воздуха и металла, образованием продуктов коррозии и так далее.
Характер разрушения поверхности металла в результате коррозии может быть различным в зависимости от свойств этого металла и условий протекания процесса. Основными видами коррозионных разрушений являются: равномерное (а), пятнами (б), точечное (в), питтинг, или углубленно точечное (г), межкристаллитное (д), растрескивающее (е), селективное или избирательное (ж).
а) б) в)
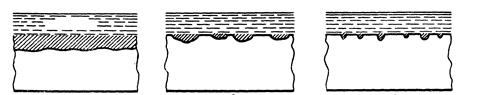
г) д) е)
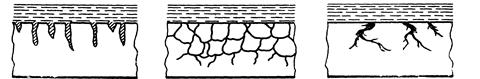
ж)
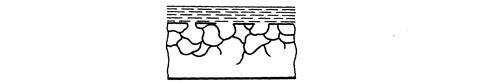
Виды коррозионных разрушений
Из всех видов коррозионных разрушений наиболее опасным является межкристаллитное, при котором ослабевают связи между зернами структуры сплава.
По механизму коррозионного процесса различают два основных типа коррозии: химическую и электрохимическую. Строго отделить один вид от другого трудно, а иногда и невозможно.
Под химической коррозией подразумевают взаимодействие металлической поверхности с окружающей средой, не сопровождающееся возникновением электрохимических (электродных) процессов на границе фаз. Она основана на реакции между металлом и агрессивным реагентом. Этот вид коррозии протекает в основном равномерно по всей поверхности металла. В связи с этим химическая коррозия менее опасна, чем электрохимическая. Делится на газовую и жидкостную.
Жидкостная коррозия протекает в среде нефти и нефтепродуктов, содержащих примеси серы. Сюда можно отнести взаимодействие металла с жидкой серой и с нефтепродуктами, содержащими серу, вообще взаимодействие металлов с жидкостями, не являющимися электролитами (ацетон, фреоны и др.).
Под электрохимической коррозией подразумевают процесс взаимодействия металлов с электролитами в виде водных растворов, реже с неводными электролитами, например, с некоторыми органическими электропроводными соединениями или безводными расплавами солей при повышенных температурах. Делится на электрокоррозию и гальванокоррозию.
Электрохимическая гальванокоррозия – наиболее распространенный вид коррозии металлов. Примером коррозионных процессов электрохимического характера является разрушение деталей машин, приборов и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, в атмосфере под адсорбированными пленками влаги, в технических растворах.
К электрохимической коррозии относятся все случаи коррозии в водных растворах. В результате окисление металла может приводить как к образованию нерастворимых продуктов (например, ржавчины), так и к переходу металла в раствор в виде ионов.
Растворенный кислород и ионы водорода – важнейшие окислители, вызывающие электрохимическую коррозию металлов.
Рассмотрим схему этого процесса. Сложность его заключается в том, что на одной и той же поверхности происходят одновременно два процесса, противоположные по своему химическому смыслу: окисление металла и восстановление окислителя. Оба процесса должны протекать сопряженно, чтобы сохранялось равенство числа электронов, отдаваемых металлом и присоединяющихся к окислителю в единицу времени. Только в этом случае может наступить стационарное состояние. По такому принципу протекают, например, взаимодействие металла с кислотами:
Zn + 2HCl → Zn2+ +2Cl– + H2.
Эта суммарная реакция состоит из двух актов:
Zn0 – 2ē → Zn2+;
2H + 2ē → H2↑.
Электрохимическая коррозия часто связана с наличием в металле случайных примесей или специально введенных легирующих добавок.
Многие химики в свое время были озадачены тем, что иногда реакция
Zn + H2SO4 → ZnSO4 + H2.
не протекает. Было выяснено, что в такой ситуации в раствор нужно добавить немного сульфата меди (II) (медного купороса). В этом случае на поверхности цинка выделится медь
CuSO4 + Zn → ZnSO4 + Cu
и водород начнет бурно выделяться. При объяснении данного явления в 1830 г. швейцарским химиком А. де-ля Ривом была создана первая электрохимическая теория коррозии.
При осаждении на поверхности цинка металлической меди получается короткозамкнутый элемент. В нем цинк является анодом, а медь – катодом. Поскольку медь находится в контакте с цинком и оба эти металла окружены раствором электролита, гальванический элемент является «включенным». Цинк в виде иона Zn2+ переходит в раствор серной кислоты, а оставшиеся от каждого атома два электрона перетекают на более электроположительный металл – медь:
Zn0 – 2ē → Zn2+.
К медному аноду подходят ионы водорода, принимают электроны и превращаются в атомы водорода, а затем и в молекулы водорода:
H+ + ē (Cu) → H0 – первичный процесс;
H0 + Н0 → H2↑ – вторичный процесс.
Таким образом, потоки движения ионов разделены и при избытке кислоты процесс протекает до тех пор, пока не растворится весь цинк.
Итак, процессы электрохимической коррозии протекают по законам электрохимической кинетики, когда общая реакция взаимодействия может быть разделена на следующие, в значительной степени самостоятельные, электродные процессы:
– анодный процесс – переход металла в раствор в виде ионов (в водных растворах, обычно гидратированных) с оставлением эквивалентного количества электронов в металле;
– катодный процесс – ассимиляция появившихся в металле избыточных электронов деполяризаторами.
Различают коррозию с водородной, кислородной или окислительной деполяризацией. При наличии в растворе газообразного кислорода и невозможностью протекания процесса коррозии с водородной деполяризацией основную роль деполяризатора исполняет кислород. Коррозионные процессы, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называют процессами коррозии металлов с кислородной деполяризацией. Это наиболее распространенный тип коррозии металла в воде, в нейтральных и даже в слабокислых солевых растворах, в морской воде, в земле, в атмосфере воздуха.
Общая схема кислородной деполяризации сводится к восстановлению молекулярного кислорода до иона гидроокисла:
O + 4ē + 2H2O → 4OH–.
В случае водородной деполяризации на катоде протекает процесс восстановления ионов водорода, находящихся в среде:
2Н++ 2ē + → Н2.
Пример.
Рассмотрим электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель.
Поскольку магний имеет меньшую величину электродного потенциала (–2,37 В), чем никель (–0,25 В), то он будет играть роль анода, а никель – роль катода. Так как металл катода является восстановленной формой, то на нем будет протекать процесс восстановления молекул кислорода, присутствующего в нейтральной среде (кислородная деполяризация), или ионов водорода, присутствующего в кислой среде (водородная деполяризация).
Электродные процессы, протекающие в нейтральной среде:
А) Mg0 – 2ē → Mg2+ – процесс окисления;
K) 2Н2О + О2 + 4ē → 4ОН– – процесс восстановления.
Образующиеся ионы магния связываются с гидроксид-ионами, с образованием гидроксида магния:
Mg2+ + 2ОН– → Mg(ОН)2 – продукт коррозии в нейтральной среде.
Схема работы данного гальванического элемента:
Mg H2O, О2 Ni
Электродные процессы, протекающие в кислой среде:
А) Mg0 – 2ē → Mg2+ – процесс окисления;
K) 2Н+ + 2ē → Н2 – процесс восстановления.
Поскольку не указана кислота, в которую погружена гальванопара магний – никель, то будем считать, что продуктом коррозии в кислой среде является соль мания (Mg2+ ).
Схема работы данного гальванического элемента:

Mg H+ Ni
Электрохимическая электрокоррозия. Электрическая коррозия (электрокоррозия) происходит под действием блуждающих токов, возникающих от посторонних источников (линии электропередач, электрические железные дороги, различные электроустановки, работающие на постоянном электрическом токе). Блуждающие токи вызывают коррозию газопроводов, нефтепроводов, электрокабелей, различных подземных металлических сооружений. Под влиянием блуждающих токов на находящихся в земле металлических предметах появляются участки входа и выхода электронов – катоды и аноды.
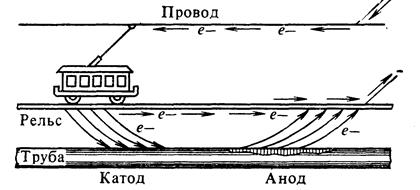
Коррозия под действием блуждающих токов
Тщательное соблюдение требований к электрической изоляции (битум, полиэтилен) закладных изделий и правильной эксплуатации электрических сетей может исключить электрокоррозию, развивающуюся, главным образом, в городах и на предприятиях.
Дата добавления: 2020-08-31; просмотров: 707;











