Рассмотрим примеры ионно-обменных реакций, сопровождающихся выполнением какого-либо из условий протекания процессов.
1Если в результате реакции выделяется нерастворимое в воде вещество (если образуется осадок (↓) (смотри таблицу растворимости)).
Молекулярное уравнение реакции растворимой соли со щелочью:
CuCl2 + 2KOH → 2KCl + Cu(OH)2↓.
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH– → 2K+ + 2Cl– + Cu(OH)2↓.
Сокращенное ионное уравнение реакции:
Cu2+ + 2OH– → Cu(OH)2↓.
Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 + 3BaCl2 → 3BaSO4↓ + 2AlCl3.
Полное ионное уравнение реакции:
2Al3+ + 3SO42– + 3Ba2+ + 6Cl– → 3BaSO4↓ + 2Al3+ + 6Cl–.
Сокращенное ионное уравнение реакции:
3Ba2+ + 3SO42– → 3BaSO4↓
2 Если в результате реакции выделяется газообразное вещество (↑).
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl → 2KCl + H2S↑.
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– → 2K+ + 2Cl– + H2S↑.
Сокращенное ионное уравнение реакции:
S2– + 2H+ → H2S↑.
Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:
 H2O
H2O
Na2CO3 + 2HNO3 → 2NaNO3 + H2CO3 .
CO2↑
Полное ионное уравнение реакции:
2Na+ + CO32– + 2H+ + SO42– → 2Na+ + SO42– + H2O + CO2↑.
Сокращенное ионное уравнение реакции:
CO32– + 2H+ → H2O + CO2↑.
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).
3 Если в результате реакции образуется малодиссоциированное вещество.
Молекулярное уравнение реакции щелочи с кислотой:
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O.
Полное ионное уравнение реакции:
Ca2+ + 2OH– + 2H+ + 2NO3– → Ca2+ + 2NO3– + 2H2O.
Cокращенное ионное уравнение реакции:
H+ + OH– → H2O.
Вода – очень слабый электролит и диссоциирует лишь в ничтожно малой степени. Равновесие между молекулами воды и ионами сильно смещено в сторону образования молекул. Поэтому практически реакция нейтрализации сильной кислоты сильным основанием протекает до конца.
4 Если образуются комплексные соединения (малодиссоциированные комплексные ионы).
Два основания способны взаимодействовать друг с другом только в том случае, если одно из них проявляет амфотерные свойства, например, Zn(OH)2, Be(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3 и т. д. В этом случае образуются комплексные соединения. Формулы соответствующих комплексных ионов:
[Zn(OH)4]2–, [Be(OH)4]2–, [Pb(OH)4]2–, [Al(OH)4]–, [Cr(OH)6]3–.
При составлении формул комплексных соединений следует дописать положительные ионы перед комплексным ионом и составить формулу согласно валентности.
Молекулярное уравнение реакции гидроксида цинка с водной щелочью:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4].
Полное ионное уравнение реакции:
Zn(OH)2 + 2Na+ + 2OH– → 2Na+ + [Zn(OH)4]– .
Cокращенное ионное уравнение реакции:
Zn(OH)2 + 2OH– → [Zn(OH)4]– .
5 Рассмотрим два примера протекания реакции с участием кислой и основной соли. Следует помнить, что кислые соли проявляют как свойства солей, так и свойства кислот, а основные – свойства солей и оснований.
Реакция взаимодействия между гидросульфидом калия и гидроксидом калия протекает в прямом направлении, поскольку в этой реакции образуется слабый электролит – вода:
KHS+ KOH → K2S + HOH.
Полное ионное уравнение:
K+ + HS– + K+ + OH– → 2K+ + S2– + HOH.
Как мы помним кислые соли хорошо диссоциируют на катионы металла и гидроанионы, поскольку являются сильными электролитами при диссоциации по первой стадии
Сокращенное ионное уравнение:
HS– + OH– → S2– + HOH.
Реакция взаимодействия между хлоридом гидроксомеди и соляной кислотой протекает в прямом направлении, поскольку в этой реакции образуется слабый электролит – вода:
CuOHCl + HCl → CuCl2 + HOH.
Полное ионное уравнение:
CuOH+ + Cl– + H+ + Cl– → Cu2+ + 2Cl– + HOH.
Как мы помним основные соли хорошо диссоциируют на гидроксокатионы металла и анионы кислотного остатка, поскольку являются сильными электролитами при диссоциации по первой стадии.
Сокращенное ионное уравнение:
CuOH+ + H+ → Cu2+ + HOH.
Составление полных ионно-молекулярных и молекулярных уравнений реакций по сокращенным ионно-молекулярным. Поскольку сокращенное ионно-молекулярное уравнение характеризует суть протекающей в растворе реакции, то для одного такого уравнения можно записать большое количество молекулярных уравнений. При выполнении такого задания, необходимо к ионам добавлять ионы противоположного знака, но с таким расчетом, чтобы получить сильный электролит.
Рассмотрим следующий пример. Реакция выражается молекулярным уравнением:
Fe2+ + S2– → FeS.
К ионам железа можно добавить отрицательные ионы, образующие с ним сильный электролит (растворимую соль) – Сl–, Br–, NO3–, SO42– и. т. д. Использовать такие ионы, как, например ОН– или СО32– нельзя, т. к. при этом получается слабый электролит Fe(ОН)2 или FeСО3, который следует записывать в виде молекулы, а нам нужны ионы.
К ионам серы следует прибавить положительные ионы, дающие сильный электролит (растворимую соль) – К+, Na+, NH4+, Ba2+. Использовать ионы Н+ не следует, поскольку при этом образуется слабая кислота – Н2S, которую следует записывать в виде молекулы, а не ионов (самая распространенная ошибка, поскольку данная кислота является растворимой, что не делает ее сильным электролитом).
После подборов необходимых ионов следует составить формулы соединений согласно валентности). Затем записывают продукты реакции так же, как и при составлении молекулярного уравнения.
Таким образом для данного ионного уравнения можно записать несколько молекулярных:
FeCl2 + K2S → FeS + 2KCl;
FeBr2 + Na2S → FeS + 2NaBr;
FeSO4 + BaS → FeS + BaSO4↓.
После составления молекулярных уравнений необходимо проверить себя и составить полные ионно-молекулярные уравнения:
Fe2+ + 2Cl– + 2K+ + S2– → FeS + 2K+ + 2Cl–;
Fe2+ + 2Br– + 2Na+ + S2– → FeS + 2Na+ + 2Br–;
Fe2+ + SO42– + Ba2+ + S2– → FeS + BaSO4↓.
Как видно, первые два уравнения соответствую данному ионному, а последнее – нет, поскольку здесь вместе с нерастворимым сульфидом железа образуется также нерастворимый сульфат бария.
6.9 Электролитическая диссоциация волы, водородный показатель среды.
Вода является слабым электролитом и в незначительной степени диссоциирует на ионы по реакции:
 H2O H+ + OH–.
H2O H+ + OH–.
Как для любого слабого электролита для нее можно записать выражение константы диссоциации:
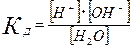 = 1,8∙10–16 (при 22 °С)
= 1,8∙10–16 (при 22 °С)
В знаменателе дроби – концентрация недиссоциированных молекул воды, которую можно считать постоянной при данной температуре и определить в 1 л, приняв массу 1 л воды за 1000 г.
[H2O] = 1000/18 = 55,56 молей.
Тогда KД = ([H+][OH–])/55,56 = 1,8∙10–16.
Отсюда [H+][OH–] = 1∙10–14 = 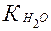 (или КВ) (ионное произведение воды).
(или КВ) (ионное произведение воды).
Как видно из уравнения электролитической диссоциации, в одном литре воды только 10–7 моль молекул распадается на ионы, образуя, соответственно, 10–7 моль ионов водорода и 10–7 моль гидроксид-ионов. Значит, концентрация ионов водорода и концентрация гидроксид-ионов в чистой воде соответственно равны [H+] = [OH–] = 10–7 моль/л. Растворы, в которых концентрация ионов водорода равна концентрации ионов гидроксида, называются нейтральными.
Физический смысл ионного произведения воды заключается в том, что оно справедливо не только для чистой воды, но и для растворов кислот, гидроксидов, солей. То есть, для воды, как и для любого водного раствора, произведение концентраций ионов H+ и OH– будет постоянной величиной, равной 10–14.
Если к воде добавить кислоту (то есть ионы водорода Н+), то концентрация ионов водорода станет больше, чем 10–7 ([H+] > 10–7 моль/л), а концентрация ионов гидроксида меньше ([OH–] < 10–7 моль/л), чем 10–7 моль/л. В кислой среде: [H+] > [OH–]
При добавлении к воде щелочи увеличивается концентрация ионов гидроксила (то есть ионов OH–). Таким образом, в щелочной среде [H+] < [OH–] Следовательно, [H+] < 10–7 моль/л, а [OH–] > 10–7 моль/л.
Однако, как бы не изменялись значения [H+] и [OH–], их произведение всегда остается равным 10–14. Зная [H+], легко подсчитать [OH–] и наоборот.
Нa практике кислотность или щелочность растворов чаще выражают именно через концентрацию ионов водорода. Чтобы избавится от отрицательной степени, для характеристики среды введено понятие водородный показатель рH – это десятичный логарифм концентрации ионов водорода, взятый с обратным знаком.
рH = –lg[H+]
Величина pH используется для характеристики кислотности раствора. Если концентрация ионов водорода равна [H+], то pH = –lg [H+].
В чистой воде pH = –lg 10–7 = 7.
В кислых растворах [H+] > [OH–] и pH < 7.
Например, в 10–3 М растворе HCl:
HCl → Н+ + Cl –;
10–3 моль/л → 10–3 моль/л,
то есть, концентрация ионов водорода в данном случае совпадает с концентрацией соляной кислоты и равна [H+] = 10–3 моль/л. Тогда pH = –lg 10–3 = 3.
В щелочных растворах [H+] < [OH–] и pH > 7.
Аналогично, логарифм концентрации ионов гидроксида с обратным знаком называют гидроксильным показателем и обозначают рОН.
рОH = –lg[OH–].
Связь между рН и рОН одного и того же раствора дается выражением:
рН + рОН = 14.
Например, в 10–2 М растворе NaOH:
NaOH → Na+ + ОН– ;
10–2 моль/л → 10–2 моль/л,
то есть, концентрация гидроксид-ионов в данном случае совпадает с концентрацией гидроксида натрия и равна [ОН–] = 10–2 моль/л. Тогда pОH = –lg 10–2 = 2. Водородный показатель среды в этом случае равен pH = 14 – pOH = 14 – 2 = 12.
Гидролиз солей.
Запишем уравнение реакции нейтрализации:
Основание + кислота → соль + Н2О.
Эта реакции протекает, поскольку в результате образуется слабый электролит – вода. Но если взять сухую соль и поместить ее в воду, то возможно протекание реакции, обратной реакции нейтрализации, в том случае, если при этом также образуется какой-либо слабый электролит:
Соль + Н2О → основание + кислота.
Таким образом, гидролизом (дословно – «разложением водой») называется процесс взаимодействия вещества с водой, при котором составные части вещества взаимодействуют с составными частями воды, образуя слабодиссоциирующие ионы или молекулы. Гидролиз в большинстве случаев является процессом обратимым; чем слабее электролит, образующий соль, тем глубже протекает процесс гидролиза. Ему подвергаются соединения различных классов, чаще всего – соли.
Три случая гидролиза солей. Помимо растворения соли в воде происходит ее гидролиз. Гидролиз всегда протекает по слабой составляющей. То есть ионы слабого составляющего соли (катион («+») или анион («–»)) связывают соответствующие ионы воды (ОН– или Н+ соответственно заряду)с образованием малодиссоциирующего соединения. Если соль образована многоосновной слабой кислотой, многоосновным слабым основание, тем и другим одновременно, то гидролиз протекает ступенчато. Количество стадий всегда определяется по заряду слабого составляющего соли. Таким образом, чтобы написать реакцию гидролиза соли, необходимо предварительно провести анализ соли.
Первый случай гидролиза – гидролиз по аниону. Соль, образованная сильным основанием и слабой кислотой, гидролизуется по аниону, в результате образуется слабо диссоциирующая кислота, а в растворе накапливаются гидроксид – ионы, создавая щелочную среду.
Рассмотрим это на примере.
Ацетат натрия СН3СООNa – соль сильного однокислотного основания NаOH и слабой одноосновной кислоты СН3СООН. При растворении в воде молекулы СН3СООNa полностью диссоциируют на ионы Na+ и СН3СОО–. Катионы Nа+ не могут связывать ионы ОН– воды, так как NаOH – сильный электролит. Анионы же СН3СОО– связывают протоны водорода воды, образуя молекулы слабого электролита СН3СООН. Таким образом, соль гидролизуется по аниону.
Соответствующие ионно-молекулярные и молекулярные уравнения реакций будут иметь вид:
 СН3СОО– + HOH СН3СООН + ОH– .
СН3СОО– + HOH СН3СООН + ОH– .
При этом мы получили краткое ионно–молекулярное уравнение реакции гидролиза, а добавив в левую и правую части ионы натрия, получим полное ионно–молекулярное и далее молекулярное уравнения гидролиза:
 СН3СОО– + Na+ + HOH СН3СООН + Na+ + ОH– .
СН3СОО– + Na+ + HOH СН3СООН + Na+ + ОH– .
 СН3СООNa + HOH СН3СООН + NaОH.
СН3СООNa + HOH СН3СООН + NaОH.
В результате гидролиза в растворе появляется некоторый избыток ионов ОН–, поэтому раствор СН3СООNa имеет щелочную реакцию ( рН > 7 ).
Если на возможность протекания гидролиза указывает ион слабого электролита (в данном случае – это ацетат-ион СН3СОО–), то реакцию среды при гидролизе определяет ион сильного электролита (в данном случае – это гидроксид-ионы ОH–, образующиеся при диссоциации NaOH).
Соли слабых многоосновных кислот гидролизуются ступенчато (с образованием кислых солей в качестве промежуточных продуктов). Рассмотрим это на примере.
Силикат калия К2СO3 – соль сильного однокислотного основания КOH и слабой многоосновной кислоты H2SiО3. При растворении в воде молекулы К2SiO3 полностью диссоциируют на ионы К+ и SiО32–. Катионы К+ не могут связывать ионы ОН– воды, так как КOH – сильный электролит. Анионы же SiО32– связывают протоны водорода воды, образуя ионы кислой соли НSiО3–. Образование молекул Н2SiО3 практически не происходит, поскольку НSiО3– диссоциирует гораздо труднее, чем Н2SiО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Однако, если повысить температуру, разбавить раствор или связать образующиеся гидроксид-ионы, то становится возможным протекание второй стадии гидролиза.
Поскольку заряд слабого составляющего соли – силикат иона (SiО32–) – «2–», то гидролиз протекает в две стадии.
Соответствующие ионно-молекулярные и молекулярные уравнения реакций будут иметь вид:
 1) SiО32– + HOH НSiО3– + ОH– ;
1) SiО32– + HOH НSiО3– + ОH– ;
 2К+ + SiО32– + HOH К+ + НSiО3– + К+ + ОH– ;
2К+ + SiО32– + HOH К+ + НSiО3– + К+ + ОH– ;
 К2SiО3 + HOH КНSiО3 + КOH;
К2SiО3 + HOH КНSiО3 + КOH;
 2) НSiО3– + HOH Н2SiО3 + ОH– ;
2) НSiО3– + HOH Н2SiО3 + ОH– ;
 К+ + НSiО3– + HOH Н2SiО3 + К+ + ОH– ;
К+ + НSiО3– + HOH Н2SiО3 + К+ + ОH– ;
 КНSiО3 + HOH Н2SiО3 + КOH.
КНSiО3 + HOH Н2SiО3 + КOH.
В результате гидролиза в растворе появляется некоторый избыток ионов ОН–, поэтому раствор К2SiО3 имеет щелочную реакцию ( рН > 7 ).
Второй случай гидролиза – гидролиз по катиону. Соль, образованная слабым основанием и сильной кислотой, гидролизуется по катиону, в результате образуется слабо диссоциирующее основание, а в растворе накапливаются ионы водорода, создавая кислую среду.
Хлорид аммония NH4Cl – соль слабого однокислотного основания NH4OH и сильной одноосновной кислоты HCl. При растворении в воде молекулы NH4Cl полностью диссоциируют на катионы NH4+ и анионы Cl–. Ионы Cl– не могут связывать ионы Н+ воды, так как HCl – сильный электролит. Ионы же NH4+ связывают гидроксид-ионы воды, образуя молекулы слабого электролита NH4ОН. Таким образом, соль гидролизуется по катиону. Соответствующие ионно-молекулярные и молекулярные уравнения реакций будут иметь вид:
 NH4+ + HOH NH4OH + H+ ;
NH4+ + HOH NH4OH + H+ ;
 NH4+ + Cl– + HOH NH4OH + H+ + Cl– ;
NH4+ + Cl– + HOH NH4OH + H+ + Cl– ;
 NH4Cl + HOH NH4OH + HCl.
NH4Cl + HOH NH4OH + HCl.
В результате гидролиза в растворе появляется некоторый избыток ионов Н+, поэтому раствор NH4Cl имеет кислую реакцию ( рН < 7 ).
В данном случае на возможность протекания гидролиза указывает ион слабого электролита – катион NH4+, а реакция среды при гидролизе определяется ионами сильного электролита – ионами водорода, образующиеся при диссоциации HCl.
Гидролиз солей, образованных многовалентным катионом протекает ступенчато, через стадии образования основных солей. Рассмотрим это на примере.
Хлорид цинка ZnCl2 – соль слабого многокислотного основания Zn(OH)2 и сильной одноосновной кислоты HCl. При растворении в воде молекулы ZnCl2 полностью диссоциируют на катионы Zn2+ и анионы Cl–. Ионы Cl– не могут связывать ионы Н+ воды, так как HCl – сильный электролит. Ионы же Zn2+ связывают гидроксид-ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 практически не происходит, поскольку они являются более сильными электролитами, чем ZnOH+. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Однако, если связывать образующиеся ионы водорода, то ион ZnOH+ в свою очередь подвергается гидролизу (вторая ступень гидролиза).
Поскольку заряд слабого составляющего соли – катиона цинка (Zn2+) – «2+», то гидролиз протекает в две стадии.
Соответствующие ионно-молекулярные и молекулярные уравнения реакций будут иметь вид:
 1) Zn2+ + HOH ZnOH+ + H+ ;
1) Zn2+ + HOH ZnOH+ + H+ ;
 Zn2+ + 2Cl– + HOH ZnOH+ + Cl– + H+ + Cl– ;
Zn2+ + 2Cl– + HOH ZnOH+ + Cl– + H+ + Cl– ;
 ZnCl2 + HOH ZnOHCl + HCl;
ZnCl2 + HOH ZnOHCl + HCl;
 2) ZnOH+ + HOH Zn(OH)2 + H+ ;
2) ZnOH+ + HOH Zn(OH)2 + H+ ;
 ZnOH+ + Cl– + HOH Zn(OH)2 + H+ + Cl– ;
ZnOH+ + Cl– + HOH Zn(OH)2 + H+ + Cl– ;
 ZnOHCl + HOH Zn(OH)2 + HCl.
ZnOHCl + HOH Zn(OH)2 + HCl.
В результате этого концентрация ионов Н+ в растворе становится больше концентрации ионов ОН– и раствор ZnCl2 приобретает кислую реакцию ( рН < 7 ).
Третий случай гидролиза – гидролиз по катиону и по аниону. Соль образованная слабым основание и слабой кислотой, гидролизуется одновременно по катиону и аниону. Очевидно, что гидролиз протекает глубже, чем в первых двух случаях. Характер среды слабо щелочной, слабокислый, нейтральный (чаще указывают рН ≈ 7).
Рассмотрим это на следующем примере. Ацетат аммония – соль, образованная слабым однокислотным основанием NH4OH и слабой одноосновной кислотой CH3COOH. В растворе CH3COONH4 полностью диссоциирует на катионы NH4+ и анионы CH3COO–. Ионы аммония связывают гидроксид-ионы воды, а ацетат-ионы – ионы водорода, образующиеся при диссоциации воды:
 CH3COO– + NH4+ + H2O CH3COOH + NH4OH;
CH3COO– + NH4+ + H2O CH3COOH + NH4OH;
 CH3COONH4 + H2O CH3COOH + NH4OH.
CH3COONH4 + H2O CH3COOH + NH4OH.
Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и слабое основание, и слабая кислота.
Реакция среды в растворах солей, образованных слабым основанием и слабой кислотой, будет меняться несущественно, рН будет зависеть от того, какой из электролитов, образовавших соль, является относительно более сильным, т. е. от их констант диссоциации (KD).
Если KD (основания) > KD (кислоты) , то pH > 7.
Если KD (основания) < KD (кислоты), то pH < 7.
В случае гидролиза CH3COONH4 KD(NH4OH) = 6,3∙10–5; KD (CH3COOH) = 1,8∙10–5, поэтому реакция водного раствора этой соли будет слабощелочной, почти нейтральной (pH ≈ 7).
Дата добавления: 2020-08-31; просмотров: 554;











