Методы защиты от коррозии
Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, снижением концентрации окислителя, изоляцией поверхности металла от окислителя, изменением состава металла и др. При разработке методов защиты от коррозии используют указанные способы снижения скорости коррозии, которые меняются в зависимости от характера коррозии и условий ее протекания. Выбор того или иного способа определяется его эффективностью, а также экономической целесообразностью.
7.7.1 Легирование металла.Методы защиты, связанные с изменением свойств коррозирующего металла, осуществляются при помощи легирования. Легирование – эффективный (хотя обычно дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава обычно вводят компоненты, вызывающие пассивирование металла. В качестве таких компонентов применяются хром, никель, вольфрам и др.
7.7.2 Защитные покрытия.Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Если наряду с защитой от коррозии покрытие служит также для декоративных целей, его называют защитно-декоративным. Выбор вида покрытия зависит от условий, в которых используется металл.
Одним из наиболее распространенных способов защиты металлов от коррозии является нанесение на их поверхность защитных пленок. При чем покрытия предохраняют от коррозии до тех пор, пока защитный слой цел. Появление в нем трещин и царапин способствует проникновению влаги и воздуха к поверхности защищаемого металла, и процесс коррозии возобновляется, причем в случае некоторых покрытий он даже ускоряется.
Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой. В зависимости от величины электродного потенциала защищаемого металла и покрытия, различают катодные и анодные покрытия.
Механизм электрохимической защиты металлов от коррозии позволяет рассмотреть течение коррозионных процессов в случаях механического повреждения металлических защитных покрытий. Здесь возможны два случая:
а) металл покрытия менее активен, чем защищаемый металл. Например, никель хорошо покрывает железо и достаточно стойко против действия разбавленных растворов кислот. В случае механического повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к никелю; анодом здесь является железо, а катодом никель. В этом случае разрушается железо, а никель остается без изменений:
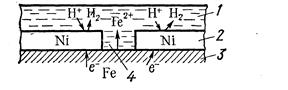
1 – раствор; 2 – покрытие; 3–основной материал; 4 – пора
Схема коррозии металла в кислом растворе при нарушении катодного покрытия
б) металл покрытия более активен, чем защищаемый металл. Например, покрытие железа цинком. При механическом повреждении цинкового покрытия возникает гальваническая пара, в которой железо служит катодом, а анодом — цинк, т. е. электроны переходят от цинка к железу, цинк разрушается, а железо остается защищенным до тех пор, пока не разрушится весь цинк. Из рассмотрения этих двух примеров можно сделать вывод, что из металлических защитных покрытий более надежным является покрытие металлом более активным, чем защищаемый металл.
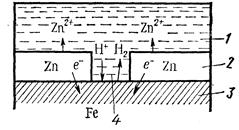
1 – раствор; 2 – покрытие; 3–основной материал; 4 – пора
Схема коррозии металла в кислом растворе при нарушении анодного покрытия
К ряду покрытий, получаемых химической обработкой металла, относятся защитные покрытия, образующиеся непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных оксидных пленок носит в технике общее название оксидирование.
Неметаллические защитные покрытия могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий могут быть неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
7.7.3 Электрохимические методы защиты.Методы электрохимической защиты основаны на изменении потенциала защищаемого металла и не связаны с изоляцией металла от коррозионной среды. К ним относятся катодная защита, называемая также электрозащитой, и протекторная (или анодная) защита.
Катодная защита заключается в том, что защищаемая конструкция А, находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду внешнего источника электричества В. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла Б (рельс, балка), присоединяемый к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается.
Протекторная защитаотличается от катодной защиты тем, что для ее осуществления используется специальный анод – протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор Бсоединяют с защищаемой конструкцией Апроводником электрического тока В. В процессе коррозии протектор служит анодом и разрушается, тем самым предохраняя от разрушения защищаемую конструкцию.
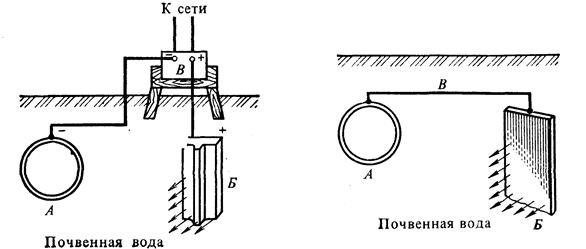
Схема катодной защиты Схема анодной (протекторной) защиты
7.7.4 Изменение свойств коррозионной среды.Изменение свойств коррозионной средыпригодно для случаев, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Один из методов состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация). В качестве примера можно привести освобождение воды, идущей на питание паровых котлов, от растворенного в ней кислорода, что достигается, например, при фильтровании воды через слой железных стружек.
Ингибиторы коррозии широко применяют при химической очистке паровых котлов от накипи, для снятия окалины с отработанных изделий, а также при хранении и перевозке соляной кислоты в стальной таре.
8.7.5 Создание рациональных конструкций.Выбор материалов и их сочетаний для данной машины, конечно, диктуется технической и экономической целесообразностью, но должен обеспечивать ее коррозионную устойчивость. Конструктор должен предусмотреть рациональные формы машины, допускающие быструю очистку от грязи; машина не должна иметь мест скопления влаги, которая является возбудителем коррозии.
Пример.
Рассмотрим электронные уравнения анодного и катодного процессов, протекающих при повреждении а) оловянного покрытия; б) цинкового покрытия на железе в растворе хлорида натрия и в растворе бромоводородной кислоты. Каков состав продуктов коррозии?
Раствор хлорида натрия имеет нейтральную реакцию среды. Функция NaCl заключается в ускорении процесса коррозии.
Поскольку железо имеет меньшую величину электродного потенциала (– 0,44 В), чем олово (– 0,25 В), то оно будет играть роль анода, а олово – роль катода. Следовательно, покрытие оловом будет являться катодным по отношению к железу.
При нарушении оловянного покрытия на железе самопроизвольно возникает гальванический элемент. Так как металл катода является восстановленной формой, то на нем будет протекать процесс восстановления молекул кислорода, присутствующего в нейтральной среде (кислородная деполяризация).
Электродные процессы:
А) Fe0 – 2ē → Fe2+ – процесс окисления;
K) 2Н2О + О2 + 4ē → 4ОН– – процесс восстановления;
Fe2+ + 2ОН– → Fe(ОН)2.
Гидроксид железа Fe(ОН)2 является неустойчивым соединением, поэтому в нейтральной среде протекает процесс его доокисления:
4Fe(ОН)2 + 2Н2О + О2 → 4Fe(ОН)3.
Далее происходит процесс отщепления молекул воды и образование оксид-гидроксида.
Fe(ОН)3 → FeООН + Н2О;
2FeООН → Fe2О3 + Н2О.
Состав продуктов коррозии будет следующим:
Fe(ОН)2, Fe(ОН)3, FeООН, Fe2О3.
Схема работы данного гальванического элемента:

Fe H2O, О2, NаCl Sn
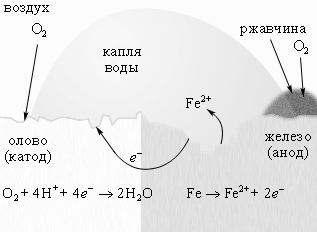
Бромоводородная кислота создает кислую среду. Как говорилось ранее, железо будет играть роль анода, а олово – роль катода. Так как металл катода является восстановленной формой, то на нём будет протекать процесс восстановления ионов водорода, образующихся при диссоциации бромоводородной кислоты.
Электродные процессы:
А) Fe0 – 2ē → Fe2+ – процесс окисления;
K) 2Н+ +2е → Н2 – процесс восстановления.
Образующиеся при окислении железа, его ионы будут взаимодействовать с образующимися при диссоциации кислоты ионами брома:
Fe2+ + 2Br– → FeBr2 – продукт коррозии.
Схема работы данного гальванического элемента:
 | |||||
 |  | ||||
Fe HBr Sn
Поскольку цинк имеет меньшую величину электродного потенциала (– 0,76 В), чем железо (– 0,44 В), то он будет играть роль анода, а железо – роль катода. Следовательно, покрытие цинком будет являться анодным по отношению к железу.
При нарушении цинкового покрытия на железе самопроизвольно возникает гальванический элемент. Так как металл катода является восстановленной формой, то на нем будет протекать процесс восстановления молекул кислорода, присутствующего в нейтральной среде (кислородная деполяризация).
Электродные процессы:
А) Zn0 – 2ē → Zn2+ – процесс окисления;
K) 2Н2О + О2 + 4ē → 4ОН– – процесс восстановления;
Zn2+ + 2ОН– → Zn(ОН)2.
Гидроксид цинка Zn(ОН)2 является продуктом коррозии. То есть разрушению подвергается покрытие (цинк), а не защищаемый металл (железо).
Схема работы данного гальванического элемента:

Zn H2O, О2, NаCl Fe
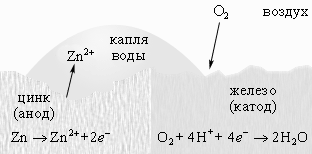
Следовательно, наиболее надежным является покрытие защищаемого металла более активным – анодное покрытие.
Дата добавления: 2020-08-31; просмотров: 524;











