Общие понятия о дисперсных системах и растворах.
Система, состоящая из двух или более веществ, в которой одно или несколько веществ измельчено и равномерно распределено в другом, называется дисперсной системой (от лат. dispersus – рассеянный).
Дисперсные (раздробленные) системы состоят из сплошной (непрерывной) фазы – дисперсионной среды и, находящихся в этой среде раздробленных частиц того или иного размера и формы, – дисперсной фазы (прерывистая часть системы).
По размеру частиц дисперсной фазы дисперсные системы делят на: грубодисперсные (взвеси), средне- и тонкодисперсные (коллоидные). Соответственно, размер частиц дисперсной фазы в первом случае превышает 1000 нм, во втором лежит в интервале от 500 до 1000 нм, и в третьем – от 1 до 500 нм.
Истинные растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе. Среди многих растворителей особое место занимает вода – это универсальный растворитель, который растворяет многие вещества.
В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано (измельчено) до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Концентрация насыщенного раствора определяется растворимостью вещества при данной температуре. Растворы с меньшей концентрацией называются ненасыщенными.
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры и т. д.).
В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси в химии называют просто растворами. Наиболее широко применяемым неорганическим растворителем является вода. Растворы с другими растворителями называются неводными.
Растворы имеют чрезвычайно большое практическое значение, в них протекают многие химические реакции, в том числе и лежащие в основе обмена веществ в живых организмах.
6.2 Коллоидные растворы. Структура и электрический заряд коллоидных частиц.
В период становления коллоидной химии «коллоидами» называли клееподобные аморфные тела (в отличие от кристаллических тел, «кристаллоидов»); теперь термин «коллоиды» – синоним высокодисперсных (микрогетерогенных) систем, то есть дисперсных систем с наиболее развитой поверхностью раздела фаз.
Коллоидные растворы по внешнему виду напоминают истинные растворы – они прозрачны. Однако при рассмотрении пути светового луча, проходящего через совершенно прозрачный коллоидный раствор, сбоку на темном фоне, то он становится видимым. Этот оптический эффект называется конусом Тиндаля.
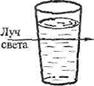
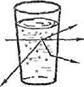
I — истинный раствор II — коллоидный раствор
(наблюдатель не видит света); (наблюдатель видит свет).
Дата добавления: 2020-08-31; просмотров: 481;











