Истинные растворы. Способы выражения состава растворов
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие концентрации.
· Массовая доля растворенного вещества ωр.в. выражается в долях единицы:
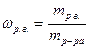 .
.
Массовая доля определяет содержание количества грамм растворенного вещества в 100 г. раствора.
· Мольная доля растворенного вещества χр.в. выражается соотношением:
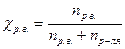 .
.
Мольная доля показывает отношение количества моль одного из компонентов системы (например, растворенного вещества) к суммарному количеству моль всех компонентов системы (например, растворенного вещества и растворителя). Сумма мольных долей компонентов раствора равна единице
К размерным концентрациям относятся следующие концентрации.
· Процентная концентрация – практически та же самая массовая доля, но выраженная в процентах:
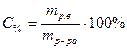 .
.
Процентная концентрация также соответствует количеству количества грамм растворенного вещества в 100 г. раствора. Выражается в %.
· Молярная концентрация (молярность) вещества в растворе рассчитывается по формуле:
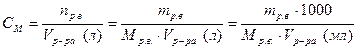 .
.
Молярная концентрация выражает содержание количества растворенного вещества в единице объема раствора, имеет размерность чаще моль/л или просто (М):
· Молярная концентрация эквивалентов (нормальная концентрация, нормальность) вещества в некотором смысле идентична молярной концентрации:
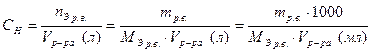 .
.
Она определяется числом моль эквивалентов растворенного вещества в единице объема раствора, имеет размерность моль/л или (н).
· Моляльная концентрация (моляльность) растворенного вещества, в отличие от предыдущих двух концентраций, относится к массе растворителя:
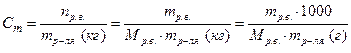 .
.
Моляльная концентрация соответствует количеству растворенного вещества в 1 кг (1000 г) растворителя, размерность моль/кг.
· Титр раствора вещества на первый взгляд похож на плотность, но:
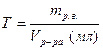 .
.
· Титр определяется массой растворенного вещества в г, содержащегося в 1 мл раствора, в отличие от плотности, которая показывает, сколько весит 1 мл раствора.
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода-ацетон, бензол-толуол, жидкие натрий-калий). Большинство соединений ограниченно растворимы (вода-бензол, вода-бутиловый спирт, вода-поваренная соль), а многие малорастворимы или практически нерастворимы (вода-BaSO4, вода-бензин).
Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым веществом и раствором. В отсутствие равновесия раствор остается стабильным, если концентрация растворенного вещества меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
Дата добавления: 2020-08-31; просмотров: 1167;











