Электронные оболочки атомов, квантовые числа. Основные принципы заполнения электронной оболочки атомов.
Согласно современным представлениям, электрон обладает одновременно свойствами волны и частицы, поэтому для описания его поведения нельзя пользоваться привычными характеристиками, такими как скорость и траектория движения. Вместо этого используют полную энергию электрона (сумма потенциальной и кинетической энергии) и вероятность обнаружения электрона в заданной области пространства.
Состояние электрона в атоме характеризуется волновой функцией, являющейся решением волнового уравнения Шредингера. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества орбитального движения и проекции этого момента на выделенное в пространстве направление. Дискретность выражается квантовыми числами: главным – n, орбитальным – l, магнитным – ml . Четвертое квантовое число – ms, называют спиновым. Волновая функция при определенных значениях трех квантовых чисел (n, l ,ml) описывает состояние электрона, характеризующееся так называемой атомной орбиталью (АО).
Каждой АО соответствует область пространства определенного размера, формы и ориентации, равноценная понятию электронного облака. Электронное облако не имеет четких границ, в связи с этим введено понятие граничная поверхность, т.е. поверхность с равной электронной плотностью, ограничивающая объем, который включает 90% заряда и массы электрона. Форма и размер граничной поверхности считается формой и размером электронного облака.
Главное квантовое число n определяет энергию электрона в атоме и среднее удаление электрона от ядра. n принимает целочисленные значения от 1 до ∞. В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами (K, L, M, N, O, P и Q) или цифрами. Буква K соответствует первому уровню, L – второму и т. д.
Уровень содержит строго определенное число электронов – максимально N= 2n2, где N – число электронов; n – номер уровня (считая от ядра) или главное квантовое число. В соответствии с уравнением, на первом, ближайшем к ядру, энергетическом уровне может находится не более двух электронов, на втором – не более 8, на третьем – не более 18, на четвертом – не более 32.
Чем меньше n, тем больше энергия взаимодействия электрона с ядром. То есть, наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней характеризуются большим запасом энергии. Поэтому они менее прочно связаны с ядром, вследствие чего могут принимать участие в образовании химических связей. Бесконечно большое значение n говорит о том, что электрон находится на бесконечно большом расстоянии от ядра, т. е. является свободным, или не связанным с ядром.
Из периодической системы для любого элемента, находящегося в невозбужденном состоянии, по номеру периода можно определить максимальное число энергетических уровней атома (№ периода = n) и то, какой энергетический уровень является внешним. Например, элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны распределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Начиная со значения главного квантового числа n = 2, энергетические уровни (слои) подразделяются на подуровни (подслои), отличающиеся друг от друга энергией связи с ядром и характеризующиеся орбитальным квантовым числом l. Число подуровней равно значению главного квантового числа: первый уровень имеет один подуровень, второй уровень – два, третий - три и т. д.
Подуровни, в свою очередь, состоят из орбиталей. Атомная орбиталь – это область пространства около ядра, в котором вероятность нахождения электрона наиболее велика (≈ 90 %). То есть, энергетическим подуровнем называется совокупность электронов с одинаковым значением n и l, поскольку орбитали одного подуровня (l = const) имеют одинаковую энергию.
Побочное (орбитальное или азимутальное) квантовое число l определяет энергию электрона на подуровне и форму атомной орбитали. Оно может принимать целочисленные значения от 0 до (n–1) (l = 0, 1, 2, …, (n–1)). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа l соответствует орбиталь особой формы. При l = 0 атомная орбиталь имеет сферическую форму (s- орбиталь). Она самая устойчивая и располагается довольно близко к ядру. Значению l = 1 соответствует атомная орбиталь, имеющая форму гантели (p-орбиталь). Изменение формы объясняется тем, что чем дальше располагается электрон от ядра, чем больше возрастает его энергия в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания и наконец превращается в гантелеобразную p-орбиталь Еще более сложную форму имеют орбитали, отвечающие более высоким значениями l, равным 2, 3 и 4 (d-, f-, g-орбитали). Таким образом, каждому цифровому значению соответствует буквенное:
| l | = | … | |||||
| l | = | s | p | d | f | g | … |
По цифровому значению l можно рассчитать число электронов на энергетическом подуровне: максимально N = 2(2l+1), где N – число электронов; l – номер подуровня.
Магнитное квантовое число ml определяет пространственное расположение атомной орбитали в пространстве относительно внешнего магнитного или электрического поля. Принимает целочисленные значения от – l до + l, включая 0. Это означает, что для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве.
Для s- орбитали (l = 0) такое положение одно и соответствует ml = 0. Гантелеобразные p-орбитали могут занимать три положения (2l + 1 = 3) вдоль осей координат пространства x, y и z: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга. Орбитали d- (2l + 1 = 5) и f- (2l + 1 = 7) могут занимать пять и семь положений соответственно.
Форма и ориентация s-, p- и d-орбиталей изображена на рисунке 1.
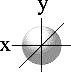
| 
|
| Одна s - орбиталь | Три p – орбитали |

| |
| Пять d – орбиталей | |

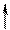 Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установлено, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ±1/2, соответствующие противоположным направлениям вращения. Электроны с разными ms обозначаются стрелками, направленными вверх и вниз .
Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установлено, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ±1/2, соответствующие противоположным направлениям вращения. Электроны с разными ms обозначаются стрелками, направленными вверх и вниз .
Все вышесказанное можно обобщить с помощью таблицы:
| Главное квантовое число | Орбитальное квантовое число | Магнитное квантовое число | Число орбиталей с данным значением l | Максимальное число электронов на подуровне | Максимальное число электронов на уровне |
| n (1 - ∞) | l (0 - (n-1)) | ml (–l- 0 -+l) | 2l + 1 | Nl = 2(2l+1) | Nn = 2n2 |
| 0 (s) | |||||
| 0 (s) | |||||
| 1 (p) | –1, 0, +1 | ||||
| 0 (s) | |||||
| 1 (p) | –1, 0, +1 | ||||
| 2 (d) | –2, –1, 0, +1, +2 | ||||
| 0 (s) | |||||
| 1 (p) | –1, 0, +1 | ||||
| 2 (d) | –2, –1, 0, +1, +2 | ||||
| 3 (f) | –3,–2,–1,0,+1,+2,+3 |
Дата добавления: 2020-08-31; просмотров: 481;











