Тема 2. Строение атома и систематика химических элементов
Основные понятия и законы химии
Основные понятия
Таким образом, можно сказать, что химия изучает материю, ее движение в целом и движение, присущее каждой ее частице.
Вещество и поле – две формы существования материи.
Вещество – форма материи, которая обладает собственной массой, т.е. массой покоя. Оно состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др.
Поле – форма существования материи, которая тесно связана с энергией.
Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Можно сказать, что эти частицы являются производными различных химических элементов.
Химический элемент – это совокупность атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. Так, например, можем найти в таблице Менделеева следующие химические элементы: 6С (углерод с зарядом ядра +6), 7N (азот с зарядом ядра +7), 8О (кислород с зарядом ядра +8) и др. Как мы видим, атомы различных химических элементов имеют различный заряд ядра. В настоящее время известно 110 (см. таблицу Д.И. Менделеева) элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем.
Атом – мельчайшая (химически неделимая) частица химического элемента, сохраняющая все его химические свойства. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро – центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра – положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N (или относительной атомной массой).
Атомы, как и любые другие частицы, имеют массу. Но масса атома ничтожно мала. Например, масса атома водорода Н равна 1,67∙10–24 г. Использовать в расчетах такое маленькое число очень неудобно. Поэтому в химии пользуются не реальными массами атомов, измеренными в граммах, а их относительными атомными массами – массами, измеренными относительно массы эталона. За эталон была взята масса 1/12 части атома элемента углерода 12С, равная 1,67∙10–24 г.
Число, показывающее во сколько раз реальная масса атома (в граммах) больше массы 1/12 части атома элемента углерода 12С, называется относительной атомной массой (Ar).
| Ar (элемента) = | реальная (абсолютная) масса атома в граммах |
| масса 1/12 части атома углерода в граммах |
Например, относительная атомная масса кислорода вычисляется следующим образом:
| Ar (О) = | 2,66∙10–24 г | = 16 |
| 1,67∙10–24 г |
Таким образом, относительная атомная масса Ar – это просто число, то естьбезразмерная величина. В качестве размерности зачастую указывают [а.е.м.] – атомных единиц массы.
Относительные атомные массы записаны в ячейках химических элементов в периодической таблице Д. И. Менделеева. Например, Ar(Fe)=55,847. Для расчетов обычно использую округленные до целых чисел значения Ar, кроме Ar хлора. Его относительная атомная масса принята округленно за 35,5.
 Порядковый номер
Порядковый номер
 Относительная атомная масса
Относительная атомная масса
| О 15,9994 кислород |
При необходимости можно определить абсолютную массу атома данного элемента, умножив относительную атомную массу на абсолютное значение атомной единицы массы:
Ar (Mg) = 24,312 а.е.м.
m (Mg) = 24,312∙1,67∙10–24 = 4,037∙10–24 г
Атомы вступают в химические реакции и складываются в молекулы.
Молекулой называется наименьшая частица вещества, которая может существовать самостоятельно, обладает химическими свойствами данного вещества и состоит из атомов одного или нескольких химических элементов. Между молекулами имеются промежутки: у газов – самые большие, у твердых веществ – самые маленькие. Молекулы двигаются беспорядочно и непрерывно. Молекулы одного вещества имеют одинаковый состав и свойства, молекулы разных веществ отличаются друг от. друга по составу и свойствам. В химических реакциях одни молекулы разрушаются и образуются другие.
Химическая формула – это условная запись состава вещества с помощью химических знаков и индексов (индекс – цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле. Например, в состав молекулы H2SO4 входят два атома водорода, один атом серы и четыре атома кислорода.
Как и атом, молекула имеет массу, которая также ничтожно мала. Относительная молекулярная масса (Mr) – безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Так, например, Mr (B2O3) = 2∙Ar(B) + 3∙Ar(O) = 2∙11 + 3∙16 = 70 а.е.м.;
Mr (KAl(SO4)2) = 1∙Ar(K) + 1∙Ar(Al) + 2∙(Ar(S) + 4∙Ar(O)) = 39 + 27 + 2∙(32 + 4∙16) = 258 а.е.м.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на значение 1 а.е.м. То есть, m (B2O3) = 70∙1,67∙10–24 = 116,9∙10–24 г
Молекулы, состоящие из атомов одного химического элемента, образуют простые вещества (Cu, H2, O3…). Поэтому можно сказать, что простые вещества являются формой существования химического элемента в свободном состоянии.
Аллотропия – явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам (аллотропных модификаций). Явление аллотропии обусловлено в одних случаях тем, что молекулы разных аллотропных модификаций состоят из различного количества атомов (например, белый фосфор состоит из молекул Р4, а красный имеет полимерную структуру), а в других – тем, что их кристаллы имеют различное строение (алмаз и графит – аллотропные модификации одного химического элемента – углерода).
Сложные вещества образованы атомами различных элементов и могут иметь состав, постоянный или меняющийся в разных пределах (Н20, Na2S04, FeCl3...).
Так как размеры и масса атомов и молекул ничтожно малы, то количество атомов и молекул в обычных образцах веществ очень велико. Поэтому при характеристике количества вещества в химии используют специальную единицу измерения – моль.
Количество вещества – число структур единиц в системе. Единицей количества вещества является моль.
Моль – это количество вещества системы, содержащее столько структурных единиц данного вещества (молекул, атомов, электронов, ионов и т. д.), сколько атомов содержится в 12 г изотопа углерода 12C. То есть, количество частиц в 1 моль любого вещества одно и то же и равно 6,02∙1023. Это число называют постоянной Авогадро (NА = 6,02∙1023 моль-1).
Понятие «моль» сродни такому понятию, как «десяток». Говорят – десяток яиц, десяток яблок и т.д., а в химии – моль молекул, моль атомов и т.п.
Масса одного моль вещества, то есть 6,02∙1023 частиц, называется молярной массой (М). Численно она равна относительной атомной массе атомной для атома, и относительной молекулярной – для молекулы. Но здесь она имеет другой смысл и другую размерность: кг/моль или г/моль. Например, М (О) = 16 г/моль, М (B2O3) = 70 г/моль.
Количество моль (количество вещества) можно найти по отношению массы всего вещества к его молярной массе:
| n (вещества) = | m |
| М |
Так, например, в 6,4 г серы содержится 6,4/32 = 0,2 моль атомов серы.
Количество моль можно рассчитать и по отношению общего количества частиц к количеству, частиц, содержащихся в одном моле (к постоянной Авогадро):
| n (вещества) = | N |
| NА |
Для газов справедливым будет соотношение:
| n (вещества) = | V |
| Vm |
В химических реакциях элементы всегда соединяются друг с другом в строго установленных соотношениях. Поэтому вводят такое понятие, как эквивалент. Термин эквивалент в химии означает равнозначное, равноценное количество. Это значит, что число эквивалентов данного вещества всегда реагирует с точно таким же количеством эквивалентов другого вещества. В качестве эталона используют эквивалент водорода, равный одному молю.
Эквивалентом (Э) называют то количество вещества, которая может замещать, присоединять или обмениваться на один моль атомов водорода ( или ½ моль атомов кислорода) в ионно-обменных реакциях или соответствует одному молю электрону в окислительно-восстановительных реакциях. Эквиваленты обычно находят по данным анализа соединений, или на основании результатов протекания химических реакций. Эквивалент измеряется в молях.
Так в соединениях HBr, H2Te, AsH3 эквиваленты элементов равны соответственно Э (Br) =1моль, Э (Te) =1/2 моля, Э (As) =1/3 моля. Это следует из того, что с одним атомом водорода, эквивалент которого равен одному молю, соединяется соответственно один, два и три атома элемента.
Для математических расчетов вводят понятие фактора эквивалентности (fэ), значение которого численно совпадает со значением эквивалента. Но в отличие от последнего фактор эквивалентности является величиной безразмерной.
Рассмотрим формулы, по которым определяется значение фактора эквивалентности соединений различных классов:
1. для элемента fэ = 1/В (валентность), fэ (Са) = 1/2;
2. для кислоты fэ = 1/О (основность, равная количеству атомов водорода), fэ (H2SO4) = 1/2;
3. для основании fэ = 1/K (кислотность, равная количеству гидроксогрупп), fэ (Сr(OH)3) = 1/3;
4. для оксида fэ = 1/n∙В (n – количество атомов элемента, В – его валентность), fэ (СuO) = 1/1∙2 = 1/2, fэ (Na2O) = 1/2∙1 = 1/2, fэ (Al2O3) = 1/2∙3 = 1/6;
5. для соли fэ = 1/n∙В (n – количество атомов металла, В – его валентность), fэ (AlPO4) = 1/1∙3 = 1/3;
6. для иона fэ = 1/ |заряд|, fэ (SO42-) = 1/2, fэ (Ti4+) = 1/4.
Масса одного эквивалента называется (М(fэ элемента) или Мэ). Для любого соединения она рассчитывается по формуле:
Мэ = М∙fэ
Молярные массы эквивалентов элементов в соединениях HBr, H2Te, AsH3 будут равны соответственно М (1Br) =80 г/моль (или Мэ (Br) =80 г/моль), М (1/2 Te) = 128/2 = 64 г/моль, (или Мэ (Te) =64 г/моль) Э (1/3 As) = 75/3 = 25 г/моль (или Мэ (As) =25 г/моль).
Для кислот, оснований, средних солей и оксидов, проявляющих основные свойства, молярная масса эквивалента может быть рассчитана как сумма молярных масс эквивалентов ионов, составляющих данное соединение:
Мэ (соединения) = Мэ∙(катиона) + Мэ (аниона)
Например, М (1/2 СuO) = М∙fэ = (64+16)∙1/2 = 40 г/моль или М (1/2 СuO) = = М (1/2 Сu) + М (1/2 О) = 64/2 + 16/2 = 40 г/моль.
Фактор эквивалентности и эквивалент сложных соединений определяется в уравнении химической реакции по отношению к количеству заместившихся или перестроившихся связей. Например:
1) NaOH + 3H3PO4 → Na3PO4 + 3H2O, fэ (H3PO4) = 1/3 (так как три атома водорода замещаются на три атома натрия, то есть три связи перестраиваются);
2) KOH + H3PO4 → KH2PO4 + H2O, fэ (H3PO4) = 1 (так как один атома водорода замещается на один атом калия, то есть одна связь перестраивается);
3) Al(OH)3 + 2HNO3 → AlOH(NO3)2 + 2H2O, fэ (Al(OH)3) = 1/2 (так как две гидроксогруппы замещаются на две группы NO3-, то есть две связи перестраиваются).
В окислительно-восстановительных реакциях эквивалентные массы окислителей и восстановителей находят иначе.
Основные законы
Важнейший закон природы – закон сохранения массы и энергии – говорит о вечности материи, о ее переходе из одной формы в другую как о форме движения:
В изолированной системе сумма масс и энергий постоянна. То есть происходит превращение одного вида материи в другой.
Изолированной системой является та система, у которой нет обмена с окружающей средой ни массой, ни энергией.
Между массой и энергией существует взаимосвязь согласно уравнению Энштейна:
Е = mc2.
Закон постоянства состава гласит:
Соотношение масс элементов, формирующих данное соединение, постоянно и не зависит от способа получения этого соединения.
Так, оксид кальция можно получить следующими способами:

Независимо от того, каким способом получено вещество СаО, оно имеет постоянный состав: один атом кальция и один атом кислорода образуют молекулу оксида кальция СаО.
Закон кратных отношений подтверждает атомное строение вещества:
В случае, когда два элемента образуют между собой несколько химических соединений, тогда имеет место отношение массы одного из элементов, приходящееся в этих соединениях на одну и ту же массу другого, как небольших целых чисел. Таким образом, элементы способны входить в состав соединений только в определенных пропорциях.
Законы постоянства состава и кратных отношений не носят всеобщего характера и не всегда справедливы. Закон кратных отношений неприменим и в случае соединений переменного состава, открытых академиком Н.С. Курнаковым в начале ХХ века (пример: оксиды титана переменного состава TiO1,46-1,56 и TiO1,9-2,0), а также в случае, когда молекула вещества состоит из большого числа атомов (например, углеводороды состава С20Н42 и С21Н44).
Закон объемных отношений справедлив для реакций, в которых присутствую газообразные вещества:
Объемы газов, участвующих в акте химического взаимодействия, относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа.
Для реакции, протекающей в газовой фазе и записанной в общем виде как
aA + bB → cC + dD
можно составить следующие соотношения:
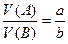 или
или 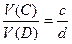 или
или 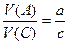 и т.д.
и т.д.
В реакции 2Н2 + О2 → 2Н2О взаимодействии 2 объемов водорода и 1 объема кислорода, образуются 2 объема водяного пара.
Закон Авогадро звучит как:
Одинаковые объемы любых газов, взятых при одной температуре и одинаковом давлении, содержат одно и тоже число молекул.
Именно из этого законы вытекает такое понятие количества вещества. Следствием закона является то, что 1 моль любого газа занимает при нормальных условиях (Р0 =101,3 кПа и Т0=298 К) объем, равный 22,4 л. Этот объем называют молярным объемом и обозначают как Vm. Следовательно, количества вещества можно также рассчитать и по формуле:
| n (вещества) = | V |
| Vm |
Для газообразных элементов используется понятие эквивалентного объема (Vэ), под которым понимают объем, занимаемый одним эквивалентом вещества. Для простых веществ, являющихся двухатомными газами (Н2, Сl2, Br2 и т.д.), при н.у. он равен 22.4/2 = 11,2 л. Как и молярную массу эквивалента, эквивалентный объе можно рассчитать по формуле:
Vэ = Vm∙fэ
Введение в химию понятия «эквивалент» позволило сформулировать закон, называемый законом эквивалентов:
Отношение масс (объемов) взаимодействующих друг с другом или образующихся в результате реакции веществ прямо пропорционально их эквивалентным массам (объемам). При решении некоторых задач удобно пользоваться другой формулировкой закона: массы реагирующих веществ пропорциональны их эквивалентным массам. Математически это можно записать следующим образом:
 или
или 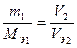
На основании данного закона решается большая часть экзаменационных задач, приведенных по данной теме.
Тема 2. Строение атома и систематика химических элементов
Дата добавления: 2020-08-31; просмотров: 445;











