СТРУКТУРА И ФУНКЦИИ ИММУННОЙ СИСТЕМЫ 13 глава
Описаны неполиморфные молекулы и из области MHC–II — DM и DQ. Функции HLA–DM в какой-то мере известны: стабилизация молекул MHC–II внутри клетки во время «ожидания» смыслового пептида и «катализ» присоединения к MHC–II смыслового пептида, а также генерация «протезного» CLIP–пептида. Гены полипептидных цепей, формирующих молекулу DQ, экспрессируются, по-видимому, только в тимусе и B–лимфоцитах, но функции этой молекулы неизвестны.
Полиморфизм классических генов MHC (классов I и II) означает наличие в популяции множества аллелей — вариантов одноимённого гена у разных особей.
Поэтому разные люди, неродственники, имеют различные аллели одноимённых генов и, следовательно, разные белки MHC на мембранах своих клеток. Вероятность существования одинаковых аллелей у неродственников, тем более совпадения по всем или многим локусам тем меньше, чем больше полиморфизм в популяции. Полиморфизм генов MHC признан наибольшим из всех известных генов человека.
Полиморфизм этих генов в популяции выгоден для выживания вида: не у одного, так у другого человека в популяции организм может быть сумеет представить T–лимфоцитам своим вариантом молекул MHC Аг того или иного (в том числе и из вновь возникающих) инфекционного микроорганизма. Но вот каждый конкретный человек либо сумеет, либо нет воспринять конкретный микробный Аг и если не сумеет, то не сможет защититься от данного микроба иммунным ответом и инфекция может убить его.
Конкретные варианты MHC закрепляются в эволюции естественным отбором (в отличие от TCR и иммуноглобулинов), и каждая отдельная особь оказывается приспособленной к регионарным видам и штаммам инфекционных микроорганизмов, на защиту от которых шел отбор MHC у предков.
Для отдельных локусов MHC известно более сотни аллельных вариантов, и поскольку далеко не каждый человек на Земле типирован по MHC, привести точное число аллелей нельзя. Международные банки данных располагают сведениями не менее чем о 349 аллелях HLA–A, 647 аллелях HLA–B, 182 аллелях HLA–C, 108 аллелях HLA–DPB1, 28 аллелях HLA–DQA1, 61 аллеле HLA–DQB1, 394 аллелях HLA–DRB1 и 81 аллеле HLA–DRB2.
Каждый отдельный аллельный вариант молекулы MHC преимущественно связывает пептиды с определёнными якорными АК–остатками.
От 1 до 10% T–лимфоцитов любого здорового организма реагируют активацией при контакте с аллогенными по MHC клетками. На любой случайный Аг, однако, реагирует гораздо меньшее число T–лимфоцитов антигенспецифичных клонов. Столь высокий уровень аллореактивности T–лимфоцитов оставался непонятным (учитывая отсутствие в природе пересадок органов и тканей) до открытия двойного распознавания Р. Цинкернагелем и П. Дохерти. Тогда стало возможным предполагать, что аллореактивность — результат перекрестной реактивности с не своими MHC TCR, отобранных при позитивной селекции в тимусе на связывание со своими MHC.
Поэтому приходится признать, что отторжение аллогенного трансплантата происходит в результате того, что 1–10% T–лимфоцитов реципиента «ошибаются», принимая донорские MHC за свои (перекрестно реагируют), тогда как 99–90% T–лимфоцитов реципиента «не видят» чужой трансплантат, поскольку на нем не те MHC, на связывание с которыми прошла позитивная селекция тимоцитов.
Почему же число генов MHC I + II у индивидуума 12 и не больше? Ведь чем больше было бы генов MHC, тем большее разнообразие Аг могли бы представлять АПК для распознавания T–лимфоцитам. Ограничение числа генов MHC можно объяснить механизмами позитивной и негативной селекции тимоцитов на связывание с MHC, представленными в тимусе во время и на месте лимфопоэза T–лимфоцитов.
Исследования показывают, что из каждого подмножества тимоцитов, оставленных живыми при позитивной селекции на связывание с конкретным вариантом молекулы MHC, 5% будет элиминировано при негативной селекции как слишком аутореактивные, т.е. каждый вариант молекул MHC «стоит жизни» 5% тимоцитов. На 12 вариантов молекул MHC (если считать только классы I и II) в тимусе должно быть ликвидировано 12´5 = 60% тимоцитов. Реально в тимусе погибает более 95% тимоцитов и лишь менее 5% выходят в периферические лимфоидные органы. Видимо, в эволюции увеличивать полигенность MHC больше было нельзя.
Есть ещё такой термин, как «гены MHC–III». Это область генома внутри комплекса MHC между I и II, в которой картированы гены, кодирующие синтез следующих белков:
1) компонентов системы комплемента C4a и C4b, C2, фактора В;
2) цитокинов — фактора некроза опухолей (TNF–a) и лимфотоксина;
3) гены 21–гидроксилазы — CYP21A, CYP21B (фермента, участвующего в биосинтезе стероидных гормонов).
До настоящего времени неизвестно, что кодирует (и кодирует ли) значительная часть ДНК этой области.
5.10. Антигенпредставляющие молекулы «не–MHC»— CD1
В организме у человека есть семейство, состоящее из 5 близкородственных генов, которые неполиморфны и кодируют соответственно 5 изоформ мембранных белков, по структуре похожих на MHC–I. Это кластер CD1: CD1a, CD1b, CD1c, CD1d, CD1e; a, b и с обладают значительной гомологией и составляют одно подсемейство, d и е — второе. Молекулы CD1 — гетеродимеры, состоящие из a–цепи с молекулярной массой 45 тыс. и b2–микроглобулина. Антигенсвязывающая «впадина» на a–цепи уже и глубже, чем у молекул MHC–I, но главное, что место связывания Аг имеет большое химическое сродство к гидрофобным лигандам. Так, Аг, которые связывают молекулы кластера CD1a, b и с, имеют гидрофобную область (цепи жирных кислот) и гидрофильную область из полярных или заряженных групп (гетерополисахариды). Например, CD1 связывают липогликаны микобактерий, состоящие из гидрофобных липидсодержащих фосфатидилинозитольных групп, связанных с крупными комплексами гидрофильных гетерополисахаридов. Какие T–лимфоциты распознают такие Аг в комплексе с CD1? Экспериментально показано, что из Tab эти Аг распознают лимфоциты, TCR которых кодируется сегментом Va24. Эти T–лимфоциты либо CD4–/CD8–, либо CD8+, по функции и те, и другие, если взаимодействуют с CD1a, b, с, ЦТЛ. CD4–/CD8– T–лимфоциты, которые взаимодействуют с CD1d, продуцируют большие количества ИЛ–4. Разные изоформы молекулы CD1 экспрессированы на различных клетках (табл. 5.5).
Таблица 5.5. Экспрессия различных изоформ молекулы CD1 на разных клетках
| Изоформа | На каких клетках экспрессирована |
| Человек | |
| 1. CD1a | Дендритные клетки; клетки Лангерганса; кортикальные тимоциты |
| 2. CD1b | Дендритные клетки; кортикальные тимоциты |
| 3. CD1c | Дендритные клетки; клетки Лангерганса; кортикальные тимоциты; B–лимфоциты |
| 4. CD1d | B–лимфоциты; эпителиальные клетки кишки; другие нелимфоидные клетки (?) |
| 5. CD1e | Неизвестно |
| Мышь | |
| 6. CD1.1 | Тимоциты; B–лимфоциты; T–лимфоциты; макрофаги; дендритные клетки; энтероциты; клетки печени |
| 7. CD1.2 | Неизвестно |
5.11. T–лимфоциты с рецептором gd для антигена (Tgd)
В экспериментах с кольцевыми ДНК перестроенных генов TCR в T–лимфоцитах обнаружены гомологичные гены, не являющиеся, однако, ни a-, ни b–генами цепей TCR. Таким образом были открыты T–лимфоциты, экспрессирующие молекулу CD3, но не экспрессирующие ни a-, ни b–цепи TCR. Такие TCR, состоящие из двух других полипептидных цепей обозначили следующими по алфавиту буквами — g и d.
О Tgd известно следующее. В эмбриогенезе Tgd появляются раньше, чем Tab. У мышей первая «волна» Tgd на 14-е сутки эмбрионального развития (у мыши период беременности 21 сут) заселяет эпителий кожи. Эти T–лимфоциты называют отростчатыми эпидермалъными T–клетками. У человека таких клеток не находят. В эмбриогенезе Tgd второй «волны» заселяют эпителий слизистых оболочек репродуктивного тракта. Эпидермальные Tgd как первой, так и второй «волны» имеют гомогенный по V–области TCR.
В постнатальной жизни из дифференцирующихся в тимусе лимфоцитов Tgd составляют меньше 1%. Также меньше 1% таких T–лимфоцитов на территории периферических лимфоидных органов и в периферической крови — это территории Tab. Но Tgd в постнатальном периоде вовсе не исчезают, они постоянно дифференцируются, причём из общей клетки–предшественницы с Tab, только экстратимически, вероятно, в слизистых оболочках преимущественно ЖКТ. Tgd нормально дифференцируются у бестимусных мышей nude.
Молекулярные механизмы «выбора» дифференцировки клетки–предшественницы в Tgd или в Tab точно неизвестны. Молекулярные генетики подозревают о существовании специальных последовательностей в ДНК — «silencers» —"выключающих» возможность перестройки и экспрессии генов TCR либо ab либо gd. Гены d–цепи локализованы внутри генов a–цепи — между Va и Ja. Поэтому d–цепи надо «успеть» перестроить свои сегменты до того, как произойдёт перестройка генов a–цепи, поскольку при перестройке генов V–J a–цепи гены d–цепи необратимо выбрасываются. Гены d–цепи содержат не менее 4 V–сегментов, диссеминированных среди V–сегментов a–цепи, 3 D–сегмента, 3 J–сегмента и один C–ген. Особенностью перестройки генов d–цепи является использование двух D–сегментов (VDDJ), при этом с каждого края блока VDDJ добавляются некодируемые нуклеотиды и это существенно повышает разнообразие антигенсвязывающих возможностей d–цепи.
Гены g–цепи TCRgd имеют два C–сегмента, 3 J–сегмента перед первым C–сегментом и 2 J–сегмента перед вторым C–сегментом, 12 V–сегментов.
В зрелых Tgd часто обнаруживают продуктивно перестроенные гены b–цепи, а в зрелых Tab — перестроенные, но непродуктивно (out-of-frame) гены g и d–цепей.
На мембране Tgd не выявили экспрессию молекулы CD4. Молекула CD8 на части Tgd экспрессирована, но не в виде ab–гетеродимера, как на CD8+ Tab, а в виде гомодимера из двух a–цепей.
Tgd распознают Аг иначе, чем Tab. По своим антигенраспознающим способностям Рц T–лимфоцитов gd напоминает иммуноглобулины в большей степени, чем другой Рц T–лимфоцитов ab. CDR3 (Complementarity–Determining Region–3) d–цепи длинная и вариабельная, как у L–цепи иммуноглобулинов, a CDR3 g–цепи короткая и не слишком вариабельная, как у L–цепи иммуноглобулинов. Как и иммуноглобулины, TCRgd способны связывать нативные Аг и независимо от классических молекул MHC, т.е. для Tgd не обязателен или вовсе не нужен предварительный процессинг Аг в АПК. В некоторых экспериментах Аг для Tgd представляют неклассические молекулы MHC (например, CD1). Разнообразие АК–состава CDR3 TCRgd больше, чем у TCRab, и больше, чем у иммуноглобулинов, т.е. в целом Tgd способны распознавать немалое множество различных Аг.
Антигены какого рода распознают Tgd? Они «замечены» в распознавании фосфолипидных Аг микобактерий, углеводов, белков теплового шока.
По функциям Tgd, как и Tab, могут быть продуцентами цитокинов и/или цитотоксическими T–лимфоцитами.
Предполагают, что Tgd локализованные в барьерных тканях и имеющие гомогенный по V–области Рц, распознают белки теплового шока (стресc–протеины), выделяемые травмированными кератиноцитами, и начинают продуцировать цитокины, которые «организуют» иммунный ответ на микробы, проникающие в организм при травме покровных тканей.
У мышей с «knock–out» по генам TCRab, но с сохранными генами TCRgd, возможен санирующий иммунный ответ против, например, вируса простого герпеса, Listeria monocytogenes, возбудителя малярии.
5.12. Субпопуляции нормальных киллеров
Нормальные киллеры (NK — Normal Killers, или Natural Killers — естественные киллеры) были описаны впервые как большие зернистые лимфоциты, способные in vitro спонтанно (т.е. без предварительной иммунизации) убивать некоторые опухолевые клетки, а также инфицированные вирусами клетки. Позже выяснили, что морфологически NK могут выглядеть и как малые лимфоциты.
NK дифференцируются из общей лимфоидной клетки–предшественницы. NK чем-то отличаются от T–лимфоцитов (в NK не перестраиваются гены TCR, и они распознают свои мишени иначе), но и чём-то похожи (в NK возникает тот же самый цитотоксический аппарат убийства клетки–мишени, что и в ЦТЛ — перфорин–гранзимы). Кстати, спонтанную цитотоксичность (без предварительной иммунизации) могут развивать и некоторые ЦТЛ.
NK в циркулирующей крови составляют около 15% от всех мононуклеарных клеток. NK в тканях локализованы в иных местах, чем T–лимфоциты: в печени (это основное место локализации NK у человека), красной пульпе селезёнки, слизистых оболочках (особенно репродуктивных органов). NK не рециркулируют между кровью и лимфой, они циркулируют только в крови.
Эффекторные функции NK — цитотоксичность (в отношении клеток–мишеней) и продукция цитокинов (ИФН–g, TNF, GM–CSF, ИЛ–5, ИЛ–8). Таким образом, будучи сами активированы, NK вносят вклад в иммунное отклонение в пользу Th1 (ИФН–g), стимулируют гемопоэз (GM–CSF), дифференцировку и мобилизацию эозинофилов (ИЛ–5), усиливают воспалительную реакцию в очаге (ИЛ–8).
Иммунное отклонение (immune deviation) — изменение терминальной дифференцировки иммунных CD4+ T–лимфоцитов в сторону преимущественного образования Th1 или Th2.
Какие стимулы активируют NK? На что они реагируют? Как и всякая клетка, NK реагируют на то, для чего у них есть Рц на мембране. У них есть Рц для цитокинов (по крайней мере для ИЛ–2 и ИФН–g) для молекул MHC–I, особый Рц для Fc–концов IgG — FcgRIIIA (CD16). Последний Рц ассоциирован в цитоплазме клетки с z–цепью (другие цепи комплекса CD3 в NK не экспрессируются), которая проводит внутрь сигнал, активирующий цитотоксический аппарат NK. Через этот Рц NK «распознают» то, что распознаёт IgG (CD16 свяжет иммунный комплекс за Fc–конец молекулы иммуноглобулина), т.е. самые разнообразные Аг. Таким образом NK осуществляют антигенспецифичную эффекторную иммунную реакцию антителозависимой клеточной цитотоксичности (АЗКЦТ). Феномен АЗКЦТ воспроизводим, его достоверно наблюдают в экспериментах in vitro. Его наличие и значение in vivo, однако, подтвердить не просто из-за отсутствия адекватных методов.
Эксклюзивным мембранным маркёром NK является мембранная молекула CD56 — изоформа адгезивной молекулы из семейства молекул адгезии клеток нервной системы (NCAM — neural cell adhesion molecule) с молекулярной массой 135–220 тыс. из надсемейства иммуноглобулинов.
У человека чётко различают по крайней мере две функционально разные субпопуляции NK: CD56много/CD16– и CD56мaло/ CD16+. Субпопуляция CD56мaло/CD16+ в АЗКЦТ является эффекторной. Субпопуляция CD56много/CD16 преобладает в печени, локализуется в синусоидах (так называемые Pit–клетки), слизистой оболочке матки и в децидуальной оболочке. Полагают, что именно NK слизистой оболочки матки «не пускают» трофобласт плода «слишком далеко» в тело матери.
Процесс инвазии трофобласта контролируется генами HLA–G (неполиморфная, неклассическая молекула класса I). NK в децидуальной оболочке имеют мембранный фенотип активированных клеток. На них экспрессированы, кроме CD56много/CD16–, ещё и такие мембранные молекулы, как CD69, MHC–II, CD45RO, CD49a (VLA–1), CD54 (ICAM–1).
В крови содержание NK с фенотипом CD56много/CD16– минимальное. Эта субпопуляция NK, кроме того, конститутивно экспрессирует высокоаффинный Рц для ИЛ–2 и способна пролиферировать в ответ на низкие концентрации ИЛ–2. NK, преобладающие в крови и селёзенке, имеют фенотип CD56мaло/CD16+. в функциональном отношении они являются эффекторами АЗКЦТ, пролиферируют в ответ на комбинации цитокинов (ИЛ–15 + ИЛ–10) или (ИЛ–15 + ИЛ–12), желательно на близком расстоянии от активированных T–лимфоцитов. Если NK стимулируют комбинацией (ИЛ–15 + ИЛ–12), то они начинают активно продуцировать ИФН–g. Если NK стимулируют комбинацией (ИЛ–15 + ИЛ–10), то они ИФН–g не продуцируют. NK начинают продуцировать ИЛ–5 только при условии их стимуляции ИЛ–2, который, как известно, продуцируют исключительно активированные T–лимфоциты, т.е. продукция ИЛ–5 нормальными киллерами возможна только после антигенспецифичного иммунного ответа со стороны T–лимфоцитов.
На NK есть Рц, способные связывать молекулы MHC–I собственных клеток. Но эти Рц не активирующие, а ингибирующие киллерную функцию NK. Ингибирующие Рц NK принадлежат ко множеству клеточных Рц KIR (Killer–cell Immunoglobulin–like Receptors). Известны две разновидности KIR, различающиеся по молекулярной массе: лёгкий KIR состоит из двух внеклеточных доменов и имеет мол. массу 58 тыс. (обозначен как р58). Он «узнаёт» Аг локуса HLA–C. Более крупный KIR имеет 3 внеклеточных домена и молекулярную массу 70 тыс. (р70), «узнаёт» HLA–B и HLA–A.
Гены KIR NK человека локализованы в хромосоме 19. На уровне ДНК они не перестраиваются, но на уровне транскрипта РНК с этих генов имеет место альтернативный сплайсинг, что обеспечивает определённую степень разнообразия вариантов этих Рц у каждого отдельного NK. На каждом единичном NK экспрессировано более одного варианта KIR–Рц. Кроме того, на NK экспрессирована молекула CD8, имеющая сродство к MHC–I.
Если при контакте с какой-то клеткой эти Рц «не находят» достаточного количества своих лигандов (MHC–I), то ингибирующий сигнал с KIR–Рц также оказывается недостаточным, и NK развивает в отношении этой клетки цитотоксическую атаку и убивает клетку. Поскольку субнормальная экспрессия MHC–I возникает при патологических процессах в клетках (при вирусных инфекциях, опухолевом перерождении), постольку и NK могут убивать инфицированные вирусами или перерожденные клетки собственного организма (в экспериментах in vitro).
Ингибирующим киллерную активность Рц NK является и мембранная молекула CD94 в комплексе с NKG2A (CD159A). Этот Рц принадлежит семейству лектинов C–типа. Ещё одним ингибирующим Рц с неизвестным лигандом служит молекула gp49B.
Контакты с клетками NK осуществляют посредством молекул адгезии [например, CD2, лиганд CD58 (LFA–3) и CD31 (PECAM1 — молекула межклеточной адгезии тромбоцитов и эндотелия 1)]. Молекула CD31 обеспечивает гомотипную адгезию NK к эндотелию и экстравазацию NK из сосудов в ткани.
Кроме того, на NK экспрессировано множество интегринов. На NK конститутивно экспрессированы такие интегрины, как CD18, LFA–1 (CD11a/CD18), Mac–1 (CD11b/CD18), VLA–4 (CD49d/CD29), VLA–5 (CD49e/CD29). LFA–1 обеспечивает связь с клетками эндотелия [лиганды — ICAM–1 (CD54) и ICAM–2 (CD102)]. Mac–1 также имеет сродство к лиганду CD54. VLA–4 вступает в связывание с сосудистой молекулой клеточной адгезии VCAM. VLA–5 обеспечивает прилипание NK к фибронектину межклеточного матрикса.
NK отвечают на (т.е. имеют Рц для) хемокины семейства «CC»: MIP–1a (macrophage inflammatory protein–1a , IP–10 (interferon–inducible protein–10), RANTES, MCP–1, 2, 3 (monocyte chemotactic protein–1, 2, 3), а также ИЛ–12.
Вероятно, NK, локализованные в синусоидах печени, через которые проходит в первую очередь кровь vena porta от слизистой оболочки всего ЖКТ, активно участвуют в убийстве лимфоцитов, активированных пищевыми Аг, и таким образом обеспечивают иммунологическую толерантность организма в целом к пище (так же, как NK слизистой оболочки матки принимают участие — может быть, решающее — в поддержании состояния толерантности организма матери к тканям эмбриона).
· Глава 6. ВОЗБУЖДЕНИЕ И ТОРМОЖЕНИЕ ИММУННОЙ СИСТЕМЫ. МЕХАНИЗМЫ ПРОВЕДЕНИЯ СИГНАЛОВ ВНУТРЬ КЛЕТКИ
6.1. Общие молекулярные механизмы проведения сигналов внутрь клетки
В многоклеточном организме ни одна нормальная клетка на стадиях развития «после зиготы» не живет исключительно по своей внутренней программе. Клетки находятся в непрерывном взаимодействии друг с другом. Всякое изменение жизненных процессов в отдельной клетке наступает только по сигналу из внешней для клетки среды. Для восприятия сигналов на внешней мембране клетки (и для некоторых сигналов на внутриклеточных органелах) есть множество специальных молекул, называемых Рц. Сигнальные молекулы химически комплементарны связывающим структурам Рц, и в общем виде их называют лигандами. Лигандами являются все биологически активные вещества — гормоны, цитокины, нейромедиаторы, патогены и продукты взаимодействия патогенов с тканями организма, ЛС. Большинство лигандов сами не проникают в клетку (некоторые, для которых есть внутриклеточные Рц, проникают), они только связывают наружный Рц. И это их единственнеое собственное биологическое свойство. Дальнейшие биологические последствия зависят от характера дифференцировки клетки, на которой экспрессирован Рц для данного лиганда. Связывание Рц изменяет его конфигурацию. Это изменение передается «влево, вправо» по мембране и «вниз» внутрь клетки, что служит началом цепи взаимодействий определённых внутриклеточных молекул — проведения сигнала (рис. 6.1). Проведение сигнала в клетку приводит к тому или иному биологическому эффекту — клеточному проявлению активации/подавления, например:
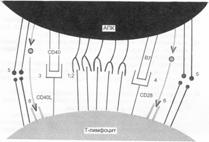
Рис. 6.1. Межклеточный «интерфейс» между T–лимфоцитом и АПК. А. Адгезия T–лимфоцита и АПК до распознавания Аг. Эти взаимодействия слабые, и если не произойдет связывания TCR с Аг, то клетки легко диссоциируют. Б. После связывания TCR с комплексом MHC — пептид изменяется конформация молекулы LFA–1 и связь между клетками становится более сильной и продолжительной.
1) изменяются адгезивные свойства клеточной мембраны — клетка становится более «липкой» по отношению к своему окружению или, наоборот, менее «липкой», что позволяет ей начать двигаться (лимфоциты и все лейкоциты);
2) клетка (лимфоциты и все лейкоциты) начинает перемещаться в тканях под действием сигналов (хемотаксис) — сквозь стенку кровеносного сосуда (экстравазация), к очагу повреждения;
3) клетка дегранулирует, выбрасывая в межклеточное пространство депонированные биологически активные вещества (тучные клетки, эозинофилы, базофилы, активированные макрофаги и нейтрофилы, цитотоксические T–лимфоциты и NK);
4) клетка вступает в пролиферацию или наоборот — перестает делиться (в периферических тканях — только лимфоциты);
5) клетка начинает (или прекращает) транскрипцию определённых генов, последующую трансляцию (синтез белка) и секрецию продукта;
6) в клетке включается «программа смерти», развивается апоптоз, и клетка прекращает своё существование.
Экспрессию тех или иных жизненных функций называют активацией клетки, подавление жизненных функций называют подавлением, или супрессией, клетки, а с ней и иммунного ответа. Соответственно существуют активирующие взаимодействия Рц—лиганд и ингибирующие взаимодействия Рц—лиганд. В некоторых случаях можно говорить об активирующих и ингибирующих Рц. Но последняя альтернатива не является строгой. Например, один и тот же TCR в случае, если он свяжет пептид–агонист и произойдут все необходимые корецепторные взаимодействия, создаст сигнал для активации лимфоцита. Но если тот же самый TCR свяжет пептид–антагонист, то активации клетки не будет. Если тот же TCR свяжет пептид-частичный агонист, то в лимфоците будет поддерживаться состояние частичной активации, которое на уровне клетки и организма выглядит как иммунологическая толерантность (см. рис. 6.1).
Исследования закономерностей взаимодействия TCR со своими лигандами показали, что не всякое связывание приводит к активации лимфоцита. Некоторые комплексы пептидов с MHC связываются с TCR, не вызывают активацию лимфоцитов и препятствуют собой связыванию с тем же TCR другого комплекса пептид—MHC, который в отсутствие первого вызывает активацию лимфоцита. Такие ингибирующие пептиды называют пептидами–антагонистами. Пептиды, вызывающие активацию с TCR, называют пептидами–агонистами. Химические исследования показывают, что пептиды–антагонисты получаются при замене в молекулах пептидов–агонистов АК, участвующих в связывании с TCR, при сохранении АК, участвующих в связывании с молекулами MHC. Вероятно, подавление активации лимфоцитов пептидами–антагонистами играет свою роль в патогенезе персистирующих вирусных инфекций. Это показано, например, для ВИЧ–инфекции: мутантные вирусные пептиды–антагонисты способны заблокировать активацию вирусспецифических CD8+ ЦТЛ, будучи в количестве в 100 раз меньшем, по сравнению с «нормальными» вирусными пептидами–агонистами, т.е. в каких-то случаях по крайней мере аффинность связи с TCR у пептида–антагониста может превосходить аффинность связи пептида–агониста.
Недавно открыт ещё один вариант взаимодействия пептидов (в комплексе с MHC) с TCR — особым, «третьим» способом: в клетке при этом наступает частичная активация. Такие пептиды назвали частичными агонистами (partial agonists or altered peptide ligands). Частичная активация заключается в неполном фосфорилировании e и z–цепей TCR и подсоединении к Рц неактивной формы киназы ZAP–70. По-видимому, аффинность связи с TCR пептидов–частичных агонистов обычно меньше аффинности связи пептидов–агонистов. Но этот «третий» вариант взаимодействия TCR с Аг представляет особый интерес для фундаментальной иммунологии, так как, вероятно, именно по такому варианту «частичных агонистов» происходит непрерывное распознавание «своего» всеми периферическими лимфоцитами (T и В). Без распознавания «своего» наши лимфоциты в нашем теле не живут (об этом свидетельствуют эксперименты на моделях мышей с трансгенами и нокаутом генов одновременно). Это распознавание защищает их от апоптоза. Но такое распознавание, не приводящее к полноразмерной активации лимфоцита, не приводит и к аутоиммунному повреждению своих тканей в норме.
Биохимические пути проведения сигналов различны для разных категорий Рц и их семейств. Ниже будут рассмотрены следующие категории Рц лимфоцитов и их клеток–партнёров по иммунному ответу (лейкоцитов):
Ú иммунорецепторы (так называют Рц, обеспечивающие непосредственные реакции на Аг, — TCR, BCR, FcR, в последнем случае есть один посредник — растворимые АТ);
Ú TOLL–подобные Рц для микробных продуктов;
Ú Рц семейства 7–членной «гармошки» для медиаторов базовой воспалительной реакции;
Ú Рц для цитокинов.
В настоящее время известно несколько конкретных внутриклеточных реакций, обеспечивающих проведение сигналов. Эти реакции во многом одинаковые для разных пар Рц–лиганд. Внутриклеточные молекулы — участники проведения сигналов — раньше называли вторичными мессенджерами (вторичными посредниками). Чтo определяет специфичность биологических последствий при разных сигналах, в большинстве случаев почти неизвестно — лишь немного, и лишь отчасти. Известны разные вторичные мессенджеры «при» TCR в T–лимфоцитах и BCR в B–лимфоцитах. Известны также разные вторичные мессенджеры при разных Рц — «для Аг», «для цитокинов», «для медиаторов воспаления».
6.1.1. Проведение сигналов с рецепторов лимфоцитов для антигенов — TCR и BCR
Для Рц лимфоцитов для Аг — TCR и BCR — описан ряд общих закономерностей восприятия и проведения активационных сигналов в клетку (рис. 6.2).
Рис. 6.2. Взаимодействия внутриклеточных молекул, участвующих в проведении сигналов с рецепторов для антигена (на примере TCR) на ядро (гены) T–лимфоцита (схема). TCR кластеризован — это непременное условие продуктивной активации лимфоцита. CD45 — трансмембранная тирозинфосфатаза, отщепляет ингибирующие фосфаты от ITAM цитоплазматических участков цепей комплекса TCR, чем способствует активации внутриклеточных тирозинкиназ семейства Src (Fyn и Lck). Киназы Src конститутивно ассоциированы с одной стороны с клеточной мембраной, с другой — с проводящими сигнал участками цепей TCR. ZAP–70 — z–associated protein–70 — тирозинкиназа с молекулярной массой 70 кД, ассоциированная с z–цепью комплекса TCR. LAT — один из адапторных белков, связывающих активированную киназу ZAP–70 с киназами Tec, активирующими дальше фосфолипазу C–г (PLCr). PLCr расщепляет фосфатидилинозитолдифосфат клеточной мембраны (PIP2) на диацилглицерол (ДАГ), который остаётся в мембране, и фосфатидилинозитол трифосфат (PIP3), который уходит внутрь клетки и участвует в высвобождении Ca2+ из депо, участвующих в дальнейших реакциях активации. PKC — протеинкиназа С, которую активирует ДАГ. NFkB — ядерный фактор транскрипции каппа В. NFAT — nuclear factor of activated T–cells — ядерный фактор транскрипции активированных T–лимфоцитов. АP–1–фактор транскрипции — димер генрегулирующих белков Fos и Jun.
Дата добавления: 2016-07-18; просмотров: 1922;











