СТРУКТУРА И ФУНКЦИИ ИММУННОЙ СИСТЕМЫ 14 глава
· Лиганд(ы) связывают несколько одноимённых Рц в кластеры (кластеризация Рц в мембране). Без кластеризации изменение конформации от «одновалентного» взаимодействия Рц–лиганд количественно недостаточно для наступления последствий на уровне всей клетки*.
Большинство препаратов Аг, используемых в экспериментах, являются мономерными и растворимыми. Однако на практике на них легко удаётся получить гуморальный иммунный ответ — выработку АТ в организме животного. Сами по себе такие Аг, очевидно, не могут вызвать кластеризацию BCR. Поэтому предполагают, что происходит следующее. BCR связывает Аг и наступает опосредованный через Рц эндоцитоз Аг. Внутри клетки Аг расщепляется, и пептидные фрагменты образуют комплексы с молекулами MHC, в таком виде экспрессируются на мембрану. B–лимфоцит начинает выступать в роли АПК для T–лимфоцита. T–лимфоцит связывает кассеты этих комплексов на поверхности B–лимфоцита, между ними формируется иммунологический синапс, и T–лимфоцит посылает B–лимфоциту необходимый для запуска продукции АТ «второй сигнал». Такое представление объясняет механизм давно известной тимусзависимости гуморального иммунного ответа на большинство белковых антигенов.
· Значительная часть биохимических реакций проведения сигнала — фосфорилирование молекул белков по остатку тирозина под действием протеин–тирозинкиназ или дефосфорилирования белков под действием фосфатаз. Изменение статуса остатков тирозина по фосфорилированности приводит к активации или инактивации белка. Процессы фосфорилирования–дефосфорилирования белков легко обратимы, осуществляются без дополнительных синтезов белков и поэтому «удобны» для быстрых и гибких адаптивных реакций клетки на внешние сигналы.
· В цитоплазматических участках сигналпроводящих цепей Рц выявлены определённые последовательности АК, содержащие остатки тирозина. Эти последовательности назвали ITAM(immunoreceptor tyrosine–based activation motifs — тирозинсодержащие активационные последовательности АК в иммунорецепторах) для активирующих сигналов и ITIM для подавляющих активность клетки сигналов. ITAM содержат 2 остатка тирозина, разделённых 9–12 АК: ...YXX[L/V]X6–9 YXX[L/V]..., где Y — остаток тирозина, X — остатки разных АК, L — остаток лейцина, V — остаток валина.
à В одном BCR содержится всего две последовательности ITAM — по одной в цитоплазматических концах молекул Iga и Igb. Именно в этих цепях — Iga и Igb — ITAM впервые и идентифицировали. В одном TCR содержится 10 последовательностей ITAM (по 1 в g-, d- и 2 e–цепях, по 3 в каждой из 2 z–цепей).
à Первыми, «обслуживают» TCR/BCR внутри клетки протеин–тирозин киназы семейства Src(читают «сарк»). Эти киназы связаны с внутренней стороной клеточной мембраны через липидные мостики, а также они «заранее» связаны низкоаффинно с ITAMs в цитоплазматических участках цепей Рц. Тирозинкиназы этого семейства характерны для разных сигналов, инициирующих деление и дифференцировку клеток. Название произошло от «вируса саркомы Рауса», потому что изначально эти киназы открыли как продукты онкогена этого вируса (v–src). Затем был открыт клеточный ген–прототип (c–src). Киназы Src фосфорилируют ITAM в цитоплазматических концах цепей Рц. Фосфорилирование по тирозину так меняет молекулу белка, что в ней возникают места, способные связывать другие белки. Запускаются «белок–белковые взаимодействия». Охарактеризованы два варианта мест связывания белков с белками: SÍ2–домен (Src homology 2) и SÍ3–домен (Src homology 3); SÍ2–домен связывает другие белки по фосфотирозину, SÍ3–домен связывает другие белки по участкам, богатым пролином.
Ú В B–лимфоцитах работают Src–киназы Fyn, Blk и Lyn, а в T–лимфоцитах — Src –киназы Fyn и Lck. В T–лимфоцитах киназа Lck конститутивно ассоциирована с цитоплазматическими доменами корецепторов CD4 и CD8, а киназа Fyn после кластеризации TCR ассоциируется с z и e–цепями.
Ú Ферментативная активность самих киназ семейства Src зависит от фосфорилированности киназного домена и C–концевого участка молекулы: фосфорилирование остатка тирозина в киназном домене приводит фермент в активное состояние, фосфорилирование остатка тирозина в C–концевом участке инактивирует фермент. Фосфорилирование в C–конце осуществляет специальный фермент — киназа Csk. Этa киназа конститутивно активна в неделящихся клетках. Противодействует киназе Csk трансмембранная тирозин–фосфатаза CD45, которая удаляет фосфат с остатка тирозина в C–конце молекул киназ семейства Src. Молекула CD45 была открыта как «общий Аг всех лейкоцитов». Таким образом, от баланса активностей киназы Csk и фосфатазы CD45 зависит, наступит или нет активация лимфоцита после агрегации его Рц для Аг. Через экспрессию разных изоформ фосфатазы CD45 регулируется порог силы сигнала, активирующего T–лимфоцит. В иммунных T–лимфоцитах и T–лимфоцитах памяти экспрессирована изоформа CD45, уже ассоциированная с цепями TCR, и порог активации иммунных T–лимфоцитов существенно ниже, чем у неиммунных T–лимфоцитов, в которых экспрессируется иная изоформа CD45 — не предассоциированная с TCR.
à Второй известный молекулярный механизм регуляции активности киназ семейства Src в клетке — это их ковалентное связывание с убиквитином через адапторный белок Cb1.
Ú Связывание с убиквитином «направляет» всякий белок на деградацию в протеасомах.
Ú Совместная агрегация Рц лимфоцитов для Аг с корецепторами (TCR с CD4 или CD8 и BCR с «CD19, CD21, CD81») значительно снижает порог чувствительности лимфоцита к активации: при наличии корецепторов для активации T–лимфоцита достаточно связать 100 одинаковых комплексов пептид–MHC, в отсутствие корецепторов необходимо не менее 10 тыс. таких комплексов, что в естественных условиях, по-видимому, не встречается. Агрегация BCR с корецепторами «CD19, CD21, CD81» снижает порог чувствительности B–лимфоцита по показателю концентрации Аг в 1000–10 000 раз.
· С фосфорилированными ITAM в цитоплазматических участках цепей Рц начинают взаимодействовать тирозинкиназы следующего этапа проведения сигнала — Syk в B–лимфоцитах и ZAP–70 в T–лимфоцитах. Киназа Syk встречается только в кроветворных клетках, киназа ZAP–70 — только в T–лимфоцитах. Обе эти киназы имеют по два домена SH2 в N–конце молекулы. Киназная активность локализована в C–конце.
à ZAP–70 активируется фосфорилированием ассоциированной с корецепторами T–лимфоцита Src–киназой Lck. Будучи активированной, ZAP–70 фосфорилирует свои субстраты — два адапторных белка LAT и SLP–76 (аналоги в B–лимфоцитах соответственно BLNK и SLP–65). Эти адапторные белки связаны с богатыми холестеролом участками внутренней стороны клеточной мембраны через липидные мостики (пальмитоилированные остатки цистеина). Физическая ассоциация проводящих сигнал компонентов с клеточной мембраной обеспечивает распространение сигнала не только внутрь клетки, но и вдоль мембраны.
· На этом этапе происходит активация киназ ещё одного семейства, встречающегося только в лимфоцитах — это киназы Tec. В B–лимфоцитах экспрессируется киназа Брутона — Btk*, в T–лимфоцитах — киназа Itk. В молекулах этих киназ есть участки, так называемые домены PH (pleckstrin–homology), позволяющие этим белкам связываться с фосфорилированными липидами внутренней стороны клеточной мембраны. Через свои SH2- и SÍ3–домены они связывают адапторные белки LAT, SLP–76, BLNK. Киназы Tec являются важными активаторами следующего участника проведения сигнала — фосфолипазы C–g.
Киназа Брутона Btk (Bruton's tyrosine kinase) — «знаменита» тем, что именно дефект в гене этого фермента обнаружен у пациентов с первичным иммунодефицитом — агаммаглобулинемией Брутона. Это заболевание — первое, открытое врачами (О.С. Брутоном в 1952 г.) — из категории врождённых генетических иммунодефицитов.
· Молекула фосфолипазы C–g (PLC–g) содержит два домена SH2, через которые она связывается с фосфотирозинами на активированных тирозинкиназах, фосфорилирующих активационные остатки тирозина в молекуле PLC–g. Будучи активированной, PLC–g начинает расщеплять фосфолипиды клеточной мембраны, а именно фосфатидилинозитолдифосфат (PIP2) на фосфатидилинозитолтрифосфат (PIP3) и диацилглицерол (ДАГ).
à Для PIP3 есть Рц в эндоплазматическом ретикулуме, он связывается с PIP3 и тем самым высвобождает ионы кальция из депо в цитозоль. В процесс активации клетки включаются и кальциевые насосы клеточной мембраны, «подкачивающие» Ca2+ из внеклеточной среды. Свободный кальций, будучи в достаточной концентрации, активирует кальцийсвязывающие белки, в том числе кальмодулин, который регулирует активность ряда других белков. В высоких концентрациях Ca2+ активирует и серин/треониновую фосфатазу — кальцийнейрин, который дефосфорилирует и тем самым активирует фактор транскрипции NFAT (nuclear factor of activated T cells; несмотря на такое название, этот фактор транскрипции не является специфичным только для T–лимфоцитов).
· ДАГ остаётся в мембране и активирует протеинкиназу С (PKC) — серинтреониновую киназу, которая активирует эволюционно «древний» фактор транскрипции NFkB.
· Следующие участники проведения сигнала — малые G–белки. Это небольшие одноцепочные белки, обладающие свойством связываться с гуанозинтрифосфатом (ГТФ). Первый из открытых малых G–белков — Ras (мол. масса 21 кДа). Он был открыт как непременный участник клеточного деления, консервативный у всех исследованных эукариотических клеток.
à Существенные участники процессов передачи сигнала — так называемые адапторные белки. Это белки, содержащие от 1 до 3 SH2- и SH3–доменов, по которым они связывают другие белки, чем обеспечивают нужные белок–белковые взаимодействия. Одним из лигандов адапторных белков являются факторы замещения гуаниннуклеотидов — GEFs (guanine–nucleotide exchange factors). Ras в неактивном состоянии содержит ГДФ. GEF из адапторного белка заменяет в Ras ГДФ на ГТФ, чем переводит Ras в активное состояние. Ras, однако, обладает собственной ГТФ–азной активностью и быстро отщепляет третий фосфат, чем возвращает себя в неактивное состояние (самоинактивируется). Описаны мутации в гене Ras, приводящие к замене всего одной АК, но с потерей способности самоинактивироваться. Клетки с таким мутантным геном становятся злокачественно опухолевыми.
à В состоянии кратковременной активации Ras успевает активировать очередной каскад киназ, называемый MAP (Mitogen–Activated Protein Kinase). Именно эти киназы MAP уже непосредственно фосфорилируют факторы транскрипциив адре клетки. В настоящее время охарактеризован фактор транскрипции АP–1 — гетеродимер белков Fos и Jun.
· Изучение внутриклеточных молекулярных механизмов действия таких иммунодепрессивных ЛС, как циклоспорин А, такролимус (FR506) и сиролимус, привело к обнаружению в клетке так называемых иммунофилинов. Иммунофилинами назвали те молекулы в клетке, с которыми указанные иммунодепрессанты вступают в непосредственное химическое взаимодействие: циклоспорин А образует комплекс с иммунофилином, названным циклофилином, такролимус — с иммунофилином FKBP (FK–Binding Protein). Иммунофилины являются ферментами — пептидил–пролил–cis–trans–изомеразами. Биологические эффекты циклоспорина А и такролимуса одинаковы: образующиеся в клетке комплексы «иммунофилин–препарат» связывают и инактивируют кальцийнейрин. В результате не активируется фактор транскрипции NFAT и не наступает транскрипция с генов ИЛ–2, CD40–лиганд, Fas–лиганд и T–лимфоцит не выходит в активацию, не наступает экспансия клона. Кальцийневрин функционирует не только в T–лимфоцитах, но и в других клетках, однако его концентрация в других клетках существенно выше, чем в T–лимфоцитах. Это и позволяет подавить активацию T–лимфоцитов дозами препаратов, к которым устойчивы другие клетки. У сиролимуса иной внутриклеточный механизм действия, чем у циклоспорина и такролимуса. Сиролимус связывается с тем же иммунофилином, что и такролимус, — FKBP, но этот комплекс не затрагивает кальцийнейрин. Комплекс сиролимус—иммунофилин связывается в клетке с некой протеинкиназой, названной mTOR (Mammalian Target Of Rapamycin) и блокирует проведение сигналов с Рц для ИЛ–2, ИЛ–4 и ИЛ–6 — соответственно блокируются пролиферация и иные проявления активации, зависящие от этих Рц.
à То, что у циклоспорина А и такролимуса, с одной стороны, и у сиролимуса — с другой разные внутриклеточные механизмы действия, позволяет использовать их комбинации в клинике с существенным снижением дозы с обеих сторон.
Кратко суммируем «ключевые слова», обозначающие процессы и молекулы, осуществляющие внутриклеточное проведение сигналов в лимфоцитах с Рц для Аг:
Ú кластеризация Рц и корецепторов;
Ú ITAM's — 2 в BCR, 10 в TCR;
Ú киназы семейства Src—Fyn, Blk, Lyn — в B–лимфоцитах, Lck и Fyn в T–лимфоцитах;
Ú киназы Syk и ZAP–70;
Ú киназы семейства Tec—Btk, Itk;
Ú фосфолипаза C–g (PLC–g);
Ú фосфатидилинозитол дифосфат (PIP2), фосфатидилилинозитол трифосфат (PIP3), диацилглицерол (ДАГ);
Ú ионы кальция (Ca2+), кальмодулин, кальцийнейрин, фактор транскрипции NFAT;
Ú протеинкиназа С (PKC), фактор транскрипции NFkB;
Ú малые G–белки (Ras);
Ú каскад киназ MAP;
Ú факторы транскрипции АP–1;
Ú иммунофилины.
6.1.2. Проведение сигналов с TOLL–подобных рецепторов, распознающих продукты микробных патогенов
У млекопитающих охарактеризованы по крайней мере два (из 10, предсказанных «геномом» человека) TOLL–подобных Рц, распознающие непосредственно микробные продукты: TLR–2, связывающий продукты грамположительных бактерий, и TLR–4, ассоциированный в клеточной мембране с CD14, лигандом для которого является ЛПС грамотрицательных бактерий. Внутриклеточный механизм проведения сигналов с этих Рц изучен (рис. 6.3). Оказалось, что таков же внутриклеточный механизм проведения сигнала с Рц для такого цитокина, как ИЛ–1 (т.е. ИЛ–1 и Рц для него — «отголосок» древней сигнальной системы многоклеточных). На выходе сигналов с этих Рц активируется фактор транскрипции NFkB.
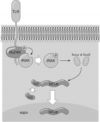
Рис. 6.3. Проведение сигналов с TOLL–подобных рецепторов для патогенов и рецепторов для ИЛ–1 (схема). В проведении сигналов участвуют адапторный белок MyD88, киназы IRAK, затем киназы Ikka и Ikkb, которые отщепляют от фактора транскрипции NFkB ингибиторный белок Ikb. «Древний» фактор транскрипции NFkB мигрирует в ядро, где инициирует транскрипцию с тех или иных генов.
Цитоплазматические участки молекул TOLL–подобных Рц и ИЛ–IR содержат характерные последовательности АК–остатков, названные TIR–доменом. Если Рц связывает лиганд, то внутри клетки его TIR–домен связывает особый адапторный белок MyD88. По другому сайту («домену смерти») MyD88 связывает особую серин/треониновую киназу IRAK. Эта киназа активируется и активирует две другие киназы — Ika и Ikb. Они формируют димер, который фосфорилирует ингибиторный белок Ikb, блокирующий фактор транскрипции NFkB. После диссоциации Ikb фактор транскрипции NFkB мигрирует в ядро, где связывается с рядом промотеров, что обеспечивает запуск транскрипции с их генов. NFkB запускает транскрипцию генов провоспалительных цитокинов и костимуляторных молекул B7.1 и B7.2 в дендритных клетках. Кроме того, в дендритных клетках инициируются процессы, обеспечивающие их мобилизацию и миграцию из очага внедрения патогена в регионарные лимфатические узлы. Таким образом, сигналы с TOLL–подобных Рц создают необходимые условия для начала лимфоцитарного иммунного ответа. Заодно NFkB иницирует транскрипцию гена своего белка–ингибитора Ikb, что обеспечивает самозатухание сигнала с TOLL–подобных Рц.
6.1.3. Проведение сигналов с рецепторов семейства 7–членных трансмембранных «гармошек»
Рц этого семейства приводят сигналы, обеспечивающие общую физиологическую функцию — базисную воспалительную реакцию в тканях. Лигандами для таких Рц являются бактериальные пептиды, содержащие N–формилметионин (fMet, с этой АК начинается трансляция всех белков у прокариот), анафилатоксины комплемента (C5a, C3a, C4a), хемокины. Такую же структуру 7–членной «гармошки» имеют фоторецепторы — родопсин и бактериородопсин.
Внутри клетки Рц семейства 7–членной «гармошки» передают сигнал на так называемые большие G–белки (ГТФ/ГДФ–связывающие белки) (рис. 6.4). К настоящему времени охарактеризовано 20 таких больших G–белков, все они тримеры, их молекулы состоят из трёх цепей — Ga, Gb, Gg. Разные G–белки проводят сигналы на различные гены в ядре клетки. В неактивном состоянии эти белки физически не ассоциированы с цитоплазматическими участками молекулы Рц, и Ga–цепь образует комплекс с ГДФ (гуанозиндифосфатом). При связывании Рц с лигандом цитоплазматический участок Рц захватывает свой G–белок, ГДФ замещается на ГТФ (гуанозинтрифосфат) и Ga–цепь диссоциирует от димера (Ga + Gb). Таким образом, активированный G–белок взаимодействует с аденилатциклазой и фосфолипазой C–g, которые катализируют образование таких активных продуктов, как циклический аденозинмонофосфат (цАМФ), фосфатидилинозитол трифосфат (РIР3) и диацилглицерол (ДАГ). Эти вторичные посредники в свою очередь активируют различные процессы в клетке — метаболизм, подвижность, пролиферацию, экспрессию генов.
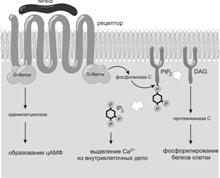
Рис. 6.4. Проведение сигналов с рецепторов семейства 7–членной «гармошки»[Рц для хемокинов, анафилотоксинов комплемента (C5a, CЗa, C4a) и бактериальных пептидов, содержащих формилметионин (fMet)]. PLC–г — фосфолипаза C–г. PLC–г расщепляет фосфатидилинозитолдифосфат клеточной мембраны (PIP2) на диацилглицерол (ДАГ), который остаётся в мембране, и инозитолтрифосфат, который уходит внутрь клетки и высвобождает Ca2+ из депо, участвующих в дальнейших реакциях активации. цАМФ — циклический аденозинмонофосфат.
6.1.4. Проведение сигналов от рецепторов к цитокинам
Проведение сигналов с Рц к цитокинам отличается быстротой, что ожидаемо в соответствии с физиологическими функциями, зависящими от цитокинов (очень быстро, но не надолго). Путь проведения сигналов с Рц для цитокинов в общем виде следующий (рис. 6.5).
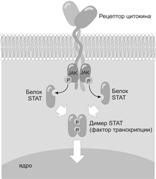
Рис. 6.5. Проведение сигналов с рецепторов для цитокинов (схема). Путь проведения сигналов с Рц для цитокинов — самый короткий из известных. Цитоплазматические участки молекул Рц опираются на киназы семейства Janus, которые фосфорилируют белки семейства STAT, последние сами и являются факторами транскрипции. Димеры (гомо- и гетеро-) STAT мигрируют в ядро, где и инициируют транскрипцию с генов.
1) цитоплазматические участки молекул Рц внутри клетки «опираются» на киназы семейства Janus;
2) киназы Janus фосфорилируют цитозольные белки семейства STAT;
3) фосфорилированные молекулы STAT димеризуются, образуя либо гомо-, либо гетеродимеры;
4) димеры STAT перемещаются в ядро и сами инициируют транскрипцию с тех или иных генов.
Разные киназы Janus и различные факторы транскрипции STAT «работают» при разных Рц для цитокинов.
Цитокины сами по себе неспецифичны по Аг, но их эффекты тем не менее реализуются в норме антигеннаправляемо. Так происходит потому, что в норме цитокины секретируются направленно в межклеточный синапс, формируемый между двумя взаимодействующими клетками. Формирование наиболее прочных синапсов происходит именно вокруг Рц лимфоцитов для Аг, связавших свои лиганды на АПК.
6.2. Ингибирующие рецепторы
Иммунологи давно знали, что если экспериментальному животному незадолго до Аг или одновременно с Аг ввести готовые АТ к данному Аг, то индукция новой продукции АТ к данному Аг не происходит, т.е. иммунный ответ при некоторых условиях не развивается при наличии Аг в организме. Относительно недавно начали разбираться в механизмах этого феномена. Обнаружили, что на лимфоцитах В, T и NK и некоторых лейкоцитах есть особые Рц, связывание которых с лигандом приводит к подавлению тех или иных процессов в клетке. В цитоплазматических участках молекул этих Рц выявили характерный рисунок последовательности АК, который назвали ITIM (immunoreceptor tyrosine–based inhibition motif — тирозинсодержащие ингибирующие последовательности АК в иммунорецепторах). ITIM — остатки одной из гидрофобных АК — изолейцина (I) или валина (V), некой АК (X), тирозина (Y), двух каких–либо АК (X, X), лейцина (L), т.е. ... [I/V] XYXXL ... . Эти последовательности ITIM в клетке ассоциированы с особыми ферментами — ингибиторными фосфатазами SHP–1 и SHP–2. Эти фосфатазы имеют 1 или больее SH2–доменов для белок–белкового взаимодействия по фосфорилированному остатку тирозина и связываются с фосфорилированным остатком тирозина в ITIM (например, SHIP — инозитолфосфатаза, которая удаляет 5'–фосфат с фосфатидилинозитол трифосфата (PIP3). Каким-то образом активность этих фосфатаз блокирует вовлечение в активацию киназ семейства Tec и фосфолипазы PLC–g. Соответственно в клетке снижается содержание фосфатидилинозитол трифосфата (РIР3) и диацилглицерола (ДАГ) и активация клетки блокируется.
Известны следующие конкретные ингибирующие Рц.
· На B–лимфоцитах:
Ú особый Fc–Рц для тяжёлых цепей молекул иммуноглобулинов класса G — FcgRIIB–1 (в цитоплазматическом участке содержится один ITIM);
Ú Рц PIR–B (paired immunoglobulin–like receptor) (содержит один ITIM, связан с ингибирующей фосфатазой SHP–1);
Ú Рц CD22 (содержит три ITIM).
· На T–лимфоцитах: Рц CTLA–4 (содержит один ITIM, связан с ингибирующей фосфатазой SHP–2).
· На цитотоксических T–лимфоцитах (ЦТЛ) и нормальных киллерах (NK) Рц из семейства KIR:
Ú KIR 2DL (содержит один ITIM);
Ú KIR 3DL (содержит один ITIM).
Среди иммуноглобулиноподобных Рц цитотоксических лимфоцитов (KIR) есть активирующие и ингибирующие. Ингибирующие KIR экспрессированы на NK и части ЦТЛ. Два названных выше Рц связывают различные молекулы MHC–I. Вариант KIR–p58 состоит из двух внеклеточных доменов и связывает Аг локуса HLA–C. Вариант KIR–p70 состоит из трёх внеклеточных доменов и связывает Аг локуса HLA–B. Описаны и другие ингибирующие Рц на NK и части (»5%) CD8+ ЦТЛ, например димер CD94–NKG2C. Этот Рц распознаёт большинство исследованных вариантов молекул MHC–I, а также неклассическую молекулу MHC–I HLA–E.
В зависимости от того, с каким активирующим Рц и на каких клетках происходит коагрегация ингибирующих Рц, выключается тот или иной тип клеточной цитотоксичности: с киллингактивирующим Рц на NK — NK–цитотоксичность; с FcgRIIIA на тех же NK–антителозависимая клеточная цитотоксичность (АЗКЦТ); с TCR — ЦТЛ-цитотоксичность.
Вероятно, именно экспрессия ингибирующих рецепторов на некоторой части иммунных лимфоцитов превращает их в пул лимфоцитов памяти.
CTLA–4 экспрессируется по мере активации и дифференцировки иммунных T–лимфоцитов. Лигандами для CTLA–4 являются мембранные молекулы CD80 и CD86, т.е. те же самые, что служат лигандами корецептора CD28 неиммунных T–лимфоцитов, привлечённых АПК к иммунному ответу. CD80 экспрессирован на B–лимфоцитах, на активированных T–лимфоцитах, моноцитах/макрофагах и дендритных клетках. CD86 экспрессирован только на активированных B–лимфоцитах и моноцитах/макрофагах. Таким образом, по мере развития процессов активации в T–лимфоцитах в них возрастает и экспрессия собственного ингибирующего Рц.
Механизм подавления продукции АТв B–лимфоцитах на Аг, АТ к которому пассивно введены в достаточном количестве в организм, представляют следующим образом. Ингибирующие Рц FcgRIIB–1 на B–лимфоцитах ко агрегируются с BCR Аг в присутствии АТ класса G (т.е. фактически иммунными комплексами). При этом активационный сигнал с BCR прерывается ингибирующими воздействиями со стороны ферментативного аппарата при FcgRIIB–1. Подобная коагрегация Рц для Аг и ингибирующих Рц FcgRIIB–1 возможна под влиянием не только Аг, но и антиаллотипических, антиидиотипических и антиизотипических АТ (рис. 6.6). Таким образом, АТ (как конечный продукт) при достижении определённой концентрации ингибируют продукцию себе подобных в своём клоне B–лимфоцитов.
Ингибирующие Рц есть не только на лимфоцитах, но и на лейкоцитах. FcgRIIB — самый широко распространённый из всех известных Рц для Fc–фрагментов иммуноглобулинов. Он экспрессирован на всех лейкоцитах. Причём если на лимфоцитах преобладает изоформа FcgRIIB–1, то на лейкоцитах миелоидного ряда — FcgRIIB–2. Лигандами для FcgRIIB–1/2 являются растворимые комплексы IgG с Аг в действующих концентрациях порядка миллиграмм на миллилитр. FcgRIIB способен модулировать (ингибировать) активацию разных лейкоцитов (тучных клеток, базофилов, эозинофилов, нейтрофилов, моноцитов, дендритных клеток), опосредованную АТ разных классов (IgE, IgA, IgG). To что лигандом этого Рц являются иммуноглобулины только класса G, придает этому классу особые иммунорегуляторные функции в разных иммунологических реакциях и процессах. Этот Рц — единственный из ингибиторных, работающий с растворимыми лигандами, остальные имеют в качестве лигандов молекулы клеточных мембран. На тучных клетках выявлен ещё один ингибирующий Рц, названный MAFA — Аг (Рц), ассоциированный с функциями тучных клеток. MAFA экспрессирован на тучных клетках и на NK (второе название — KLRG1), причём на тучных клетках он конститутивно ассоциирован с высокоаффинным Рц для IgE — FceRI. Лиганд неизвестен, предположительно молекула лиганда содержит углеводы. При коагрегации с FceRI MAFA подавляет активацию тучных клеток. В цитоплазматическом участке молекула MAFA содержит одну последовательность ITIM.
На тучных клетках и NK обнаружена мембранная молекула gp49B1, которая коагрегирует с активирующим Рц FceRI и предположительно является ингибирующим Рц. Однако лиганд для gp49B1 неизвестен. Предположение может не подтвердиться.
6.3. Апоптоз — программируемая гибель клетки
Несмотря на то, что окружающая среда, как правило, нестерильна, внутренняя среда организма в норме сохраняет стерильность. Следовательно, борьба с инфекциями — постоянная составляющая жизненного процесса. Факты показывают, что при массированных вирусных инфекциях до 50% всех периферических CD8+ T–лимфоцитов составляют вирусспецифические клоны (таковы масштабы экспансии клонов при иммунных ответах). В острый период инфекционных заболеваний можно прощупать и даже увидеть увеличенные лимфатические узлы. Однако когда организм выздоравливает, количество лимфоцитов возвращается к норме. В отсутствие острых инфекционных воспалительных процессов поддерживается достаточно строгий гомеостаз числа лимфоцитов и в периферической крови, и в тканях. Поэтому насколько для лимфоцитов обязательна пролиферация в начале развития любого иммунного ответа, настолько же для лимфоцитов обязательна гибель по завершении иммунного ответа. Закономерная гибель отработавших лимфоцитов происходит по механизму апоптоз а. Второе название того же явления — программируемая смерть клетки.
Запрограммированность апоптоза означает, что в клетке доступны для активации внешними сигналами определённые гены («программа смерти»), кодирующие определённые продукты — ферменты, предназначенные для закономерной и необратимой дезинтеграции всей ДНК клетки и остального содержимого клетки. Но в нормальных клетках апоптоз не запускается по сугубо внутриклеточной программе развития отдельно взятой клетки. Нужен внешний сигнал. Для его восприятия на клетках, в жизненном цикле которых апоптоз является физиологическим, есть специальные Рц, т.е. существуют сигналы и Рц клеточной смерти.
Но, кроме того, отсутствие сигналов с других Рц, характеризующих жизненную активность клетки (эти сигналы называют сигналами на выживание), также при определённых условиях позволяет клетке выйти в апоптоз. Примером сигнала на выживание (и, следовательно, предотвращения апоптоза) является удовлетворительное связывание TCR с MHC–I или MHC–II при позитивной селекции тимоцитов в тимусе. Для периферических T–лимфоцитов сигналом на выживание вне режима развития иммунного ответа служит связывание с комплексами MHC с эндогенными пептидами — частичными агонистами (т.е. непрерывное узнавание своего).
Дата добавления: 2016-07-18; просмотров: 2179;











