СТРУКТУРА И ФУНКЦИИ ИММУННОЙ СИСТЕМЫ 16 глава
· При первом иммунном ответе произошло размножение лимфоцитов антигенспецифичного клона, и не все из них израсходованы в текущем иммунном ответе, не все претерпевают апоптоз. Часть лимфоцитов клона «замораживается» и персистирует в организме в течение неопределённого времени (для различных Аг время очень разное — от нуля до пожизненного). Оценка количества лимфоцитов, например иммунных CD8+ T–лимфоцитов, на которых произошла экспрессия ингибирующих Рц, показывает, что это единицы процентов в сумме по всем клонам.
· Лимфоциты памяти существенно меньше, чем неиммунные лимфоциты, нуждаются в медиаторах доиммунного воспаления и в костимуляторных сигналах, чтобы начать иммунный ответ на свой Аг, и могут начать его вне воспаления или при минимальных симптомах воспаления.
Несмотря на то что как клинический феномен «иммунологическая память» был известен с древних времён (практика иммунизации у античных греков и китайцев), клеточные и молекулярно–генетические механизмы иммунологической памяти до настоящего времени неизвестны. Неизвестно, почему на какие-то Аг иммунологическая память остаётся, на какие-то нет, на какие-то надолго, на какие-то быстро исчезает, а у различных особей — по-разному. Поэтому в настоящее время прогнозы результатов вакцинации — только эмпирические и статистические, но персонально их нельзя составить разумно при нынешнем уровне знаний. Одно из сомнений заключается в том, что, возможно, продолжительная иммунологическая память сохраняется лишь в тех случаях и на тот период времени, когда и пока в организме остаётся персистирующий Аг в виде латентной инфекции или каком-то ином виде.
Соотношение первичного иммунного ответа, вторичного ответа и ответа иммунологической памяти схематически показано на рис. 7.2.

Рис. 7.2. Первичный иммунный ответ, вторичный иммунный ответ и ответ иммунологической памяти. Такого рода соотношение величин первичного иммунного ответа, вторичного иммунного ответа и ответа иммунологической памяти бывает при введении в организм неразмножающихся Аг. Ответ иммунологической памяти бывает не всегда, и интенсивность его весьма различна в разных случаях. 1 — первичный иммунный ответ; 2 — вторичный иммунный ответ; 3 — ответ иммунологической памяти.
Параметры вторичного ответа по B–лимфоцитам в сравнении с первичным иммунным ответом приведены в табл. 7.1.
Таблица 7.1. Параметры B–лимфоцитов при первичном и вторичном иммунном ответе
| Параметр | При первичном ответе | При вторичном ответе |
| Частота встречаемости Аг–специфичных B–лимфоцитов в лимфоидных тканях | 10–4–10–5 | 10–3 |
| Изотип продуцируемых АТ | IgM >IgG | IgG, IgA, IgE |
| Аффинность АТ | Низкая | Высокая |
T–лимфоциты памяти отличаются от зрелых неиммунных T–лимфоцитов и по частоте встречаемости антигенспецифичного клона в лимфоидной ткани (больше в 10–100 раз), и по экспрессии ряда мембранных молекул. Главное, что T–лимфоциты памяти существенно меньше, чем впервые активируемые к иммунному ответу лимфоциты, нуждаются в костимулирующих воздействиях и поэтому быстрее и легче выходят в продуктивную эффекторную фазу иммунного ответа. Сравнительная экспрессия мембранных молекул на неиммунных зрелых T–лимфоцитах и на T–лимфоцитах памяти приведена в табл. 7.2.
Таблица 7.2. Относительная экспрессия мембранных молекул на зрелых неиммунных T–лимфоцитах и T–лимфоцитах памяти
| Мембранная молекула, основные функции | Относительный уровень экспрессии | |
| неиммунные T–клетки | T–клетки памяти | |
| LFA–3 (CD58), лиганд для CD2; участвует в адгезии и подаче сигнала | | |
| CD2, участвует в адгезии и активации | | |
| LFA–1 (CD11a/CD18), участвует в адгезии и активации | | |
| VLA–4, обеспечивает хоминг в ткани | | |
| CD44, обеспечивает хоминг в ткани | | |
| CD45RO, изоформа трансмембранной тирозинфосфатазы CD45 с наименьшей молекулярной массой | | |
| CD45RA, изоформа трансмембранной тирозинфосфатазы CD45 с наибольшей молекулярной массой | | |
| L–селектин, хоминг в лимфатические узлы | Много | На некоторых много, на некоторых мало |
| CD3, инвариантный компонент TCR |
Молекула CD45 — трансмембранная тирозинфосфатаза, состоящая из одной полипептидной цепи. Ген CD45 имеет не менее 7 экзонов, 3 из которых, А, В и С, кодируют часть внеклеточного участка молекулы и могут подвергаться альтернативному сплайсингу на уровне первичного транскрипта РНК. Изоформа CD45RA содержит пептидные участки всех 3 экзонов А, В и С, поэтому она имеет наибольшую молекулярную массу. CD45RA экспрессируется на неиммунных зрелых T–лимфоцитах, и на них этот фермент не ассоциирован в мембране ни с TCR, ни с корецепторами. В иммунных T–лимфоцитах экзоны А, В и С удаляются альтернативным сплайсингом РНК, и в белок транслируется лёгкая изоформа CD45RO. Но главное, что в иммунных T–лимфоцитах эта тирозинфосфатаза уже не независимо присутствует где-то на мембране клетки, а ассоциирована с TCR и корецепторами и способствует существенному снижению (на два порядка и более) порога активации лимфоцита Аг (рис. 7.3).
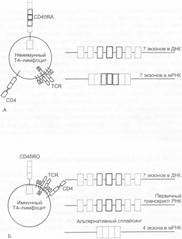
Рис. 7.3. Структура изоформ молекулы CD45 на неиммунных T–лимфоцитах и T–лимфоцитах памяти. А. В зрелом неиммунном T–лимфоците все 7 экзонов CD45 в ДНК транскрибируются в РНК и транслируются в большой белок (тяжёлая изоформа молекулы CD45A на неиммунных лимфоцитах). Молекулы TCR, CD45, CD4 разобщены в мембране клетки. Б. В иммунных T–лимфоцитах в результате альтернативного сплайсинга РНК CD45 выщепляются три экзона и в белок транслируются только 4 оставшихся (лёгкая изоформа CD45RO у иммунных лимфоцитов). Молекулы TCR, CD45, CD4 приближены друг к другу в мембране клетки.
В описанной выше последовательности событий иммунного ответа не учтен целый ряд параметров: химическая природа Аг (патогена), доза Аг и его способность к размножению внутри организма, входные ворота, влияние Аг на другие системы организма (нервную, эндокринную и др.), наличие адъювантов и т.д. В реальной ситуации все это имеет значение и, более того, определяет как саму возможность развития иммунного ответа, так и его качество, и преобладание тех или иных эффекторных механизмов иммунитета (антителозависимые процессы, ЦТЛ, макрофагзависимые процессы, эозинофилозависимые процессы и т.д.). Разнообразие конкретных форм иммунного ответа описано в главе 8. Здесь же подчеркнём два специфичных именно для иммунного ответа процесса — признака, позволяющего отличить иммунный ответ от других защитных биологических механизмов, несмотря на тесное переплетение и взаимосвязи одного с другим в едином организме: это пролиферация лимфоцитов и иммунологическая память.
7.3. Взаимодействия клеток в иммунном ответе
В процессе развития иммунного ответа происходят взаимодействия разных клеток друг с другом: клеток покровных тканей с лимфоцитами, лимфоцитов с эндотелием стенки сосуда, T–лимфоцитов с АПК, T–лимфоцита с B–лимфоцитом, T–лимфоцитов с лейкоцитами, лимфоцитов и лейкоцитов с межклеточным матриксом и т.д.
Каковы механизмы взаимодействия клеток друг с другом внутри многоклеточного организма? Известны по крайней мере два и их варианты.
· Межклеточные контакты мембранами — адгезия клеток: мембранные молекулы одной клетки комплементарно связываются с мембранными молекулами другой клетки.
· Одна клетка синтезирует и секретирует растворимое вещество, на мембране другой(их) клетки(ок) есть молекула, способная комплементарно связать именно это вещество (Рц — по определению). Цитоплазматические связи Рц обеспечивают проведение сигнала внутрь клетки, вызывающее определённые изменения внутриклеточного метаболизма, которые называют реакцией клетки (или биологическим эффектом).
Во втором варианте есть два существенно разных подварианта — дистантные и локальные взаимодействия.
à Дистантно осуществляются взаимодействия нервной системы с другими клетками организма и взаимодействия эндокринных гормонов с клетками–мишенями.
à Локально осуществляется множество межклеточных взаимодействий, в том числе в процессе развития иммунного ответа. В последнем случае растворимые вещества или медиаторы называют цитокинами(от греческих корней цито — клетка и кинос — движение, изменение, т.е. вещества, предназначенные вызывать изменения в клетках–мишенях). В отличие от контактных взаимодействий мембранными молекулами, которые достаточно инертны во времени, взаимодействия с помощью цитокинов гораздо более быстрые, оперативные, динамичные.
Уточним понятие комплементарного взаимодействия. Это строгое химическое и количественное понятие. Между двумя молекулами устанавливаются химические связи 4 типов: ионные, водородные, ван–дер–ваальсовы и гидрофобные. Сила связи характеризуется константой диссоциации (Kd). Для взаимодействия иммунорецепторов с Аг Kd должна иметь показатель степени по абсолютной величине не ниже 7, т.е. 10–7–10–11 М. Для связи пептидов–Аг с молекулами MHC–I/II характерна Kd порядка 10–6. Для связей цитокинов с Рц для цитокинов Kd составляет 10–10–10–12 М, приводится и 10–15 М. Чем больше по абсолютной величине показатель степени в значении константы диссоциации, тем при меньших концентрациях действующего вещества достигается значимый биологический эффект. Из всех известных биологически активных веществ (по крайней мере из имеющих значение для иммунологии) Kd для цитокинов наибольшие, что свидетельствует о высокой биологической активности низких концентраций цитокинов.
7.3.1. Молекулы межклеточной адгезии
Номенклатура молекул межклеточной адгезии, используемая в настоящее время, не рациональная: для одной и той же молекулы существует более чем одно обозначение. Названия, как правило, отражают экспериментальную систему, в которой молекула была впервые идентифицирована. Тем не менее по структурному принципу выделяют 4 семейства молекул межклеточной адгезии (табл. 7.3):
1) селектины;
2) муциноподобные сосудистые адрессины;
3) интегрины;
4) молекулы из надсемейства иммуноглобулинов (IgSF — immunoglobuline superfamily).
Таблица 7.3. Молекулы адгезии клеток
| Наименование | Экспрессия | Лиганды |
| СЕЛЕКТИНЫНачинают взаимодействие между лейкоцитом и эндотелием | ||
| L–селектин(CD62L) | Неиммунные лимфоциты; некоторые лимфоциты памяти; нейтрофилы; моноциты; эозинофилы | Углеводы: сульфатированный сиалил Lewisx; GlyCAM–1; CD34; MAdCAM–1 |
| P–селектин(CD62P) | Активированный эндотелий; тромбоциты | Cиалил–Lewisx; PSGL–1 |
| Е–селектин(CD62E) | Активированный эндотелий | Cиaлил–Lewisx |
| МУЦИНОПОДОБНЫЕ СОСУДИСТЫЕ АДРЕССИНЫСвязывают L–ceлектин при инициации взаимодействия лейкоцита с эндотелием | ||
| CD34 | Эндотелий; стволовые кроветворные клетки | L–селектин |
| GlyCAM–1 | Высокий эндотелий венул | То же |
| MadCAM–1 | Эндотелий венул в слизистых оболочках | L–селектин; |
| ИНТЕГРИНЫСвязывают разные молекулы адгезии на клетках и молекулы внеклеточного матрикса. Обеспечивают сильное связывание | ||
| | Моноциты, макрофаги, T–лимфоциты, дендритные клетки, нейтрофилы | ICAM–1; ICAM–2; ICAM–3 |
| | Нейтрофилы, моноциты, макрофаги | ICAM–1; iC3b; фибронектин |
| | Дендритные клетки, макрофаги, нейтрофилы | iC3b |
| | Лимфоциты, моноциты, макрофаги | VCAM–1 |
| | Моноциты, макрофаги | Фибронектин |
| | Лимфоциты | MAdCAM–1 |
| | Внутриэпителиальные лимфоциты | Е–кадгерин |
| Надсемейство иммуноглобулиновЛиганды для интегринов | ||
| CD2 (LFA–2) | T–лимфоциты | LFA–3 |
| ICAM–1 (CD54) | Лимфоциты, дендритные клетки, активированный эндотелий | LFA–1, Mac–1 |
| ICAM–2 (CD102) | "Спокойный» эндотелий, дендритные клетки | LFA–1 |
| ICAM–3 (CD50) | Лимфоциты | LFA–1 |
| LFA–3 (CD58) | Лимфоциты, АПК | CD2 |
| VCAM–1 (CD106) | Активированный эндотелий | VLA–4 |
Селектины — молекулы на поверхности лимфоцитов и лейкоцитов, а также эндотелия, которые обеспечивают избирательный (селективный) хоминг определённой клетки через стенку сосуда в определённой ткани. Общим в молекулярной структуре селектинов, которые содержат лишь одну трансмембранную полипептидную цепь, является наличие во внеклеточной части лектиноподобного домена. Лектины — белки, способные комплементарно связывать сахара.
Лигандами для селектинов являются так называемые адрессины — муциноподобные молекулы на поверхности эндотелия. Адрессины CD34 и GlyCAM–1 экспрессированы на клетках высокого эндотелия посткапиллярных венул в лимфатических узлах. САМ — Cell Adhesion Molecules (молекулы клеточной адгезии). Адрессин MAdCAM–1 (Mucosal Adressin Cell Adhesion Molecule–1) экспрессирован на эндотелии сосудов в слизистых оболочках и «ловит» лимфоциты, предназначенные для функционирования в слизистых оболочках. Селектины и адрессины обеспечивают относительно слабую адгезию клеток, достаточную для селективной остановки клетки в нужном органе, но недостаточную для проникновения сквозь стенку сосуда и миграции по межклеточному матриксу (рис. 7.4). Для более сильных взаимодействий нужны интегрины и молекулы адгезии надсемейства иммуноглобулинов. Молекулы этих же семейств обеспечивают взаимосвязи лимфоцитов с АПК и в дальнейшем лимфоцитов–эффекторов с их клетками–мишенями или клетками–партнёрами.
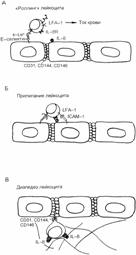
Рис. 7.4. Этапы процесса экстравазации лимфоцитов и лейкоцитов из крови в ткани. A. Стадия «роллинга». Лейкоцит «причаливает» к эндотелию в результате взаимодействий молекул Е–селектина на эндотелии с молекулами S-LeX на лейкоците и «катится» вдоль стенки сосуда (rolling). Б. Стадия прилипания. Между лейкоцитом и клетками эндотелия устанавливаются дополнительные, более сильные взаимосвязи через молекулы ИЛ–8R—ИЛ–8 и LFA–1—ICAM–1. B. Стадия диапедеза. На лейкоците экспрессируются молекулы CD31 (те же, что обеспечивают контакт между клетками эндотелия), и лейкоцит с их помощью внедряется в межэндотелиальную связь и проникает сквозь стенку сосуда в ткань (диапедез).
Все интегрины — гетеродимеры, состоящие из более крупной a–цепи и меньшей по размеру b–цепи. Интегрины группируются в подсемейства на основании общей b–цепи. Их два варианта — b1 и b2. К интегринам принадлежат молекулы LFA–1,2,3. LFA–1 — наиболее важный интегрин для активации любого T–лимфоцита, так как АТ к LFA–1 способны блокировать активацию как неиммунных, так и иммунных T–лимфоцитов. Однако анализ врождённых генетических дефектов молекул адгезии у человека показывает, что другие интегрины, например CD2 из подсемейства b1, способны компенсировать отсутствие LFA–1. VLA (very late activation antigens) — поздние Аг активации. Эти интегрины экспрессируются на T–лимфоцитах на 2–4-е сутки от начала активации и имеют наибольшее функциональное значение для проникновения уже иммунного T–лимфоцита в очаг воспаления, где ему надлежит организовать санацию от Аг.
Надсемейство иммуноглобулиноввключает в себя собственно иммуноглобулины, Рц T–лимфоцитов для Аг (TCR), корецепторные молекулы T–лимфоцитов CD4, CD8 и B–лимфоцитов CD19, инвариантные домены молекул MHC, а также ряд молекул межклеточной адгезии — ICAM (Intercellular Adhesion Molecules — ICAM–1, 2 и 3). ICAM–1 и ICAM–2 экспрессированы на эндотелии и АПК. ICAM–3 экспрессирована только на лейкоцитах и играет существенную роль при взаимодействии T–лимфоцитов с АПК.
Неиммунные T–лимфоциты, попав в T–зависимую зону лимфатического узла (и любого другого периферического лимфоидного органа), активно, но обратимо «прилипают» ко всем доступным АПК благодаря взаимодействиям LFA–1, CD2 и ICAM–3 на T–лимфоците с ICAM–1, ICAM–2, LFA–1 и LFA–3 на АПК. Во время этого «прилипания» TCR пытается узнать свой комплекс «пептид–MHC». Если узнавание произошло, то сигнал с агрегированных TCR и корецепторов (CD4 или CD8) идёт в клетку, и среди прочих последствий этого сигнала ранним является изменение конформации молекулы LFA–1, усиливающее её связь с ICAM–1 и ICAM–2. Связь между T–лимфоцитом, узнавшим свой Аг, и АПК поддерживается несколько дней, во время которых происходит пролиферация клона T–лимфоцитов. Дочерние клетки клона также прилипают к АПК на все время, пока идёт их дифференцировка в лимфоциты–эффекторы.
Существенная закономерность развития иммунного ответа состоит в том, что одного только факта связывания Рц для Аг с Аг недостаточно для того, чтобы лимфоцит активировался к иммунному ответу (т.е. начал пролиферировать и дифференцироваться). Недостаточно для активации и описанных выше адгезивных взаимодействий, недостаточно и корецепторных связей CD4 или CD8 с MHC. Все перечисленное необходимо. Но для того чтобы начался процесс пролиферации лимфоцита, необходимо ещё одно взаимодействие T–лимфоцита с той же АПК: это взаимодействие молекулы B–7 на АПК с молекулой CD28 на T–лимфоците. Известно две разновидности молекулы B–7: B–7.1 (CD80) и B–7.2 (CD86). Структурно они подобны — это гликопротеины гомодимеры, принадлежат к надсемуйству иммуноглобулинов (IgSF). CD28 тоже гомодимер и принадлежит к IgSF. Таким образом, экспрессия молекул B–7 — важнейший признак профессиональных АПК.
Активация уже иммунных лимфоцитов не зависит от CD28. Предположительно корецептором активации иммунных T–лимфоцитов является индуцибельная мембранная молекула, названная ICOS. Молекула ICOS имеет 19% гомологии с молекулой CD28. Возможно, что ICOS работает и при реактивации иммунных лимфоцитов памяти, и на эффекторном этапе работы иммунного лимфоцита в очаге деструкции повреждённой ткани.
Активация T–лимфоцита Аг происходит при сочетанном взаимодействии некоторых молекул на поверхности T–лимфоцита с рядом комплементарных молекул на поверхности АПК. Это взаимодействие принимает форму, получившую название иммунологического синапса (см. рис. 7.1). В экспериментах на лимфоцитах от трансгенных по генам TCR мышей (у которых все T–лимфоциты имеют одинаковый TCR, Аг для которого точно известен) можно прямо наблюдать эти структуры под флюоресцентным микроскопом высокого разрешения.
Иммунологический синапс имеет нечто материально общее с нервными синапсами, а именно в синаптической щели и нервного и иммунологического синапса присутствует протеогликан — агрин. В нейромышечном синапсе агрин обеспечивает кластеризацию Рц со стороны мышечной клетки. В иммунологическом синапсе T–лимфоцит синтезирует агрин, секретирует его в синаптическую щель, и там этот протеогликан обеспечивает кластеризацию TCR и корецепторов. Взаимодействующие молекулы мембран между двумя клетками иногда называют ещё межклеточным интерфейсом. Интерфейс между T–лимфоцитом и АПК состоит из молекул: со стороны T–лимфоцита — TCR/CD3/CD45, CD4 или CD8, CD28, CD40L; со стороны АПК комплементарные молекулы–лиганды соответственно пептид— MHC–I или II, MHC–II или MHC–I, B–7, CD40.
Известные пары «Рц–лиганд», вовлекаемые в процессы костимуляции лимфоцитов со стороны АПК, представлены в табл. 7.4.
Таблица 7.4. Пары «рецептор–лиганд», участвующие в костимуляции при взаимодействии T–лимфоцитов с АПК
| Рецепторы на T–лимфоците | Лиганды на АПК |
| CD28 | B7.1 (CD80); B7.2 (CD86) |
| CTLA–4 (CD152) | B7.1 (CD80); B7.2 (CD86) |
| CD40L (CD154) | CD40 |
| OX40 | OX40L |
| HSA | HSA |
| LFA–1 | ICAM–1 (CD54); ICAM–2 (CD102); ICAM–3 (CD50) |
| CD2 | LFA–3 (CD58) |
| VLA–4 | VCAM–1 (CD106) |
| CD99 | ? |
| CD95 (Fas) | FasL |
Примечания. CD99 находится в процессе изучения. Поликлональная стимуляция T–лимфоцитов in vitro АТ к CD3 плюс АТ к CD99 индуцирует повышение внутри клеток уровня свободного Ca2+, а также биосинтез TNF–a и ИФН–g что характерно для Тh1. Воздействия на Th2 при этом не выявлено. Результаты стимуляции T–лимфоцитов через молекулу Fas зависят от стадии развития T–лимфоцита: если АТ к CD3 плюс АТ к молекуле Fas воздействовать на неиммунный T–лимфоцит, то произойдет индукция апоптоза. Если той же парой АТ воздействовать на иммунный T–лимфоцит памяти, то сначала будет индуцирована пролиферация лимфоцита, затем лимфоцит претерпит индуцированную активацией клеточную смерть (AICD). Если на неиммунные Т4–лимфоциты воздействовать указанной парой АТ, но в присутствии ИЛ–4, то эти лимфоциты также сначала пролиферируют наподобие лимфоцитов памяти.
7.3.2. Антигенпредставляющие клетки. Дендритные клетки
Существенное различие между антигенраспознающими молекулами-иммуноглобулинами и антигенраспознающими молекулами–Рц T–лимфоцитов состоит в том, что иммуноглобулины (АТ) связывают нативные молекулы Аг, тогда как TCRab не связывают нативные Аг, но способны «увидеть» и связать только определённые структуры на поверхности клеток своего организма, а именно комплексы молекул MHC с пептидами, т.е. до T–лимфоцита и для T–лимфоцита Аг поглощают, перерабатывают и экспрессируют на своей поверхности другие клетки. Это и объясняет облигатную зависимость развития иммунного ответа от доиммунного воспаления. Доиммунное воспаление заключается в непосредственном связывании патогена (распознавании патогена) и поглощения его некими клетками в месте внедрения патогена — в естественных условиях это покровные ткани. Существует понятие профессиональных АПК. Таких клеток у человека и млекопитающих 3 типа:
Ú дендритные клетки костномозгового происхождения;
Ú B–лимфоциты;
Ú макрофаги.
Если лимфоцит свяжет Рц специфический Аг, но не получит одновременно и от той же АПК костимуляторный сигнал «B–7–CD28», то не просто не начнется активация лимфоцита, а произойдет такое изменение состояния лимфоцита, которое называют анергией. Лимфоцит в состоянии анергии рефрактерен к возможной стимуляции. Эта закономерность лежит в основе так называемой периферической толератности T–лимфоцитов к тканям собственного организма.
Характеристика АПК представлена в табл. 7.5.
Таблица 7.5. Свойства профессиональных АПК
| Тип АПК | |||
| Свойство | дендритные клетки | B–лимфоциты | макрофаги |
| Рц для патогенов (или их первичных акцепторов) | TOLL–подобные Рц | Рц для компонентов активированного комплемента | Рц для маннозы; Рц для ЛПС; TOLL–подобные Рц |
| Способ поглощения Аг | Эндоцитоз; макропиноцитоз; инфекция вирусов | Опосредованный Рц (Ig) эндоцитоз | Фагоцитоз; эндоцитоз |
| Экспрессия MHC | Конститутивная ++++ | Конститутивная, возрастает при активации, от +++ до ++++ | Индуцируемая бактериями или цитокинами от — до +++ |
| Костимуляторная активность | Конститутивная | Индуцируемая, от — до +++ | Индуцируемая от — до +++ |
| Какие Аг представляют | Белки, аллергены (?), вирусные Аг | Растворимые Аг, токсины, вирусные Аг | Фагоцитируемые Аг (частицы, бактериальные) |
| Локализация в организме | Барьерные ткани, лимфоидные органы | Лимфоидные органы, периферическая кровь | Соединительная ткань, паренхиматозные органы и полостей |
Если у B–лимфоцитов и макрофагов есть и иные, причём главные для этих клеток, функции — продукция иммуноглобулинов у B–лимфоцитов, фагоцитоз и экспансивное «переваривание» у макрофагов, — то у дендритных клеток, насколько это известно в настоящее время, нет иных функций в организме, кроме как представлять Аг и костимулирующие сигналы лимфоцитам.
Известно, что первичный иммунный ответ возможен только с участием дендритных клеток — ДК (не макрофагов и не B–лимфоцитов). Какой именно конкретный характер примет иммунное воспаление или разовьется иммунологическая толерантность, вероятно, тоже определяется на уровне именно дендритных клеток (ДК).
Термин «дендритные» отражает внешний облик клеток под микроскопом — клетки с отростками. В развитии иммунных процессов участвуют 3 разных типа клеток, в названии которых присутствует определение «дендритные». 2 типа — костномозгового происхождения: лимфоидные дендритные клетки — ДК2 и миелоидные дендритные клетки — ДК1. Именно эти клетки — профессиональные АПК. Третий тип — фолликулярные дендритные клетки (ФДК) — уникальные клетки стромы лимфоидных фолликулов. Они, скорее всего, не костномозгового происхождения, и функции у них особые (обеспечение возрастания аффинности иммуноглобулинов со временем по мере развития иммунного ответа), они не профессиональные АПК.
Значительная часть фактической информации о дендритных клетках получена в экспериментах с их культивированием и изучением in vitro. Эта методология не позволяет надежно отличать природные закономерности от культуральных артефактов. Поэтому приводимая характеристика ДК не является «прописной истиной». Но есть и данные исследований in vivo. У человека эти клетки происходят из общей лимфоидной клетки–предшественницы, из которой развиваются T– и B–лимфоциты, NK. На ДК есть маркёры лимфоцитов (CD2, CD5, CD7 и мРНК a–цепи пре-T–Рц для Аг) и не определяются маркёры, характерные для миелоидных ростков клеток (CD11c, CD13, CD33, Рц для маннозы). Маркёрами предшественников лимфоидных ДК человека являются вариант молекулы Рц для ИЛ–3 — ИЛ–3Ra и экспрессия одного из двух иммуноглобулиноподобных Рц (ILT3+ или ILN1–).
Большинство иммунологов полагают, однако, что есть две разновидности дендритных АПК: лимфоидные (их обозначали ДК2) и миелоидные, происходящие из моноцитов (их обозначали ДК1). Если принять такую дуалистическую точку зрения, то ДК1, вероятно, можно рассматривать как разновидность макрофагов, специализирующихся на представлении Аг T–лимфоцитам.
Дендритные клетки широко распространены в организме. Их много в покровных тканях (клетки Лангерганса в коже), лимфоидных органах.
Дата добавления: 2016-07-18; просмотров: 2865;











