Уравнение состояния идеального газа (уравнение Менделеева—Клапейрона). Изопроцессы
План ответа
1. Уравнение состояния.
2. Уравнение Менделеева— Клапейрона.
3. Процессы в газах.
4. Изопроцессы.
5. Графики изопроцессов.
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, наливают уравнением состояния.
Для произвольной массы газа состояние газа описывается уравнением Менделеева—Клапейрона: pV = mRT/M, где р — давление, V — объем, т — масса, М — молярная масса, R — универсальная газовая постоянная. Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К (R = 8,31 Дж/(моль • К)).
Уравнение Менделеева—Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемыe в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют три процесса: изотермический, изо-хорный и изобарный.

 Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермическим называют процесс, протекающий при постоянной температуре: Т = const. Он описывается законом Бойля—Мариотта: pV = const.
Изохорным называют процесс, протекающий при постоянном объеме: V = const. Для него справедлив закон Шарля: р/Т = const.
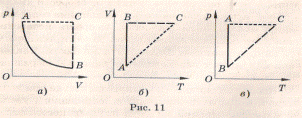
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T = const при p = const и называется законом Гей-Люссака. Все изопроцессы можно изобразить графически. На рисунке 11 представлены в различных координатах графики процессов: изотермического (изотерма АВ), изобарного (изобара АС) и изохорного (изохора ВС).
Реальные газы удовлетворяют уравнению состояния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда, в котором находится газ) и при не слишком низких температурах (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
Билет № 9
Дата добавления: 2016-07-18; просмотров: 3701;











