Внутренняя энергия. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам. Адиабатный процесс
План ответа
1. Внутренняя энергия и ее изменение.
2. Работа в термодинамике.
3. Первый закон термодинамики.
4. Применение первого закона термодинамики к изопроцессам.
5. Адиабатный процесс.
Каждое тело имеет вполне определенную структуру, оно состоит из частиц, которые хаотически движутся и взаимодействуют друг с другом, поэтому любое тело обладает внутренней энергией. Внутренняя энергия это величина, характеризующая собственное состояние тела, т. е. энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, ионов) и энергия взаимодействия этих частиц. Внутренняя энергия одноатомного идеального газа определяется по формуле
U = 3/2 • т/М ■ RT.
Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. Существует два способа изменения внутренней энергии: теплопередача и совершение механической работы (например, нагревание при трении или при сжатии, охлаждение при расширении).
Теплопередача это изменение внутренней энергии без совершения работы: энергия передается от более нагретых тел к менее нагретым Теплопередача бывает трех видов: теплопроводность (непосредственный обмен энергией между хаотически движущимися частицами взаимодействующих тел или частей одного и того же тела); конвекция (перенос энергии потоками жидкости или газа) и излучение (перенос энергии электромагнитными волнами) Мерой переданной энергии при теплопередаче является количество теплоты (Q).
Эти способы количественно объединены в закон сохранения энергии, который для тепловых процессов читается так: изменение внутренней энергии замкнутой системы равно сумме количества теплоты, переданной системе, и работы внешних сил, совершенной над системой. АС/ = Q + А, где AU — изменение внутренней энергии, Q — количество теплоты, переданное системе, А — работа внешних сил. Если система сама совершает работу, то ее условно обозначают А'. Тогда закон сохранения энергии для тепловых процессов, который называется первым законом термодинамики, можно записать так: Q = А' + + AU, т. е. количество теплоты, переданное системе, идет на совершение системой работы и изменение ее внутренней энергии.
При изобарном нагревании газ совершает работу над внешними силами А' = p(V2 - V1 = pAV, где V1 и V2 — начальный и конечный объемы газа.
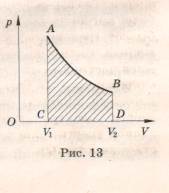
Если процесс не является изобарным, величина работы может быть определена площадью фигуры ABCD, заключенной между линией, выражающей зависимость p(V), и начальным и конечным объемами газа (рис. 13).
Рассмотрим применение первого закона термодинамики к изопроцессам, происходящим с идеальным газом.
В изотермическом процессе температура постоянная, следовательно, внутренняя энергия не меняется. Тогда уравнение первого закона термодинамики примет вид: Q = А', т. е. количество теплоты, переданное системе, идет на совершение работы при изотермическом расширении, именно поэтому температура не изменяется.
В изобарном процессе газ расширяется и количество теплоты, переданное газу, идет на увеличение его внутренней энергии и на совершение им работы: Q = AU + А'.
При изохорном процессе газ не меняет своего объема, следовательно, работа им не совершается, т. е. А = 0, и уравнение первого закона имеет вид Q = V, т. е. переданное количество теплоты идет на увеличение внутренней энергии газа.
Адиабатным называют процесс, протекающий без теплообмена с окружающей средой. Q = 0, следовательно, газ при расширении совершает работу за счет уменьшения его внутренней энергии, следовательно, газ охлаждается, А' = АС/. Кривая, изображающая адиабатный процесс, называется адиабатой.
Билет № 11
Дата добавления: 2016-07-18; просмотров: 2348;











