ОБЩИЕ СВОЙСТВА РАСТВОРОВ
РАСТВОРЫ. ДИСПЕРСНЫЕ СИСТЕМЫ
Вещества, вступающие в контакт между собой, могут дать:
· новые вещества, если между ними произошло химическое взаимодействие;
· механическую смесь компонентов, если никакого взаимодействия не происходит и смесь образуется только за счёт механического перемешивания;
· раствор, процесс образования которого занимает промежуточное положение между химическими и механическими процессами.
ОБЩИЕ СВОЙСТВА РАСТВОРОВ

Растворы состоят из растворителя и одного или нескольких растворённых веществ, особенно важное значение имеют водные растворы.
Процессы гидратации приводят к появлению различных форм связанной воды(рис. 3.1).
· химически связанная вода не сохраняется в виде молекул, но при определённых условиях может быть выделена в свободном состоянии. Химически связанная вода содержится в гидроксидах, кислых солях, горных породах;
· кристаллизационная вода образуется при кристаллизации из насыщенных водных растворов, например: затвердевший строительный гипс CaSO4· 2H2О);
· вода в гидрогелях, например в силикагелях: SiO2· nH2O. В данном случае вода в свободном состоянии, служит средой, в которой распределены частицы кремнезёма SiO2;
· адсорбированная вода поглощается поверхностью твёрдых тел и может находиться как в свободном состоянии в случае физической адсорбции, так и в связанном состоянии в случае хемосорбции;
· вода в капиллярах находится в свободном состоянии и отличается тем, что всасывается в капилляр, если его стенки смачиваются водой, и выталкивается из капилляра в случае не смачиваемых стенок капилляра.
Образование растворов происходит самопроизвольно, следовательно, изменение энергии Гиббса растворения:

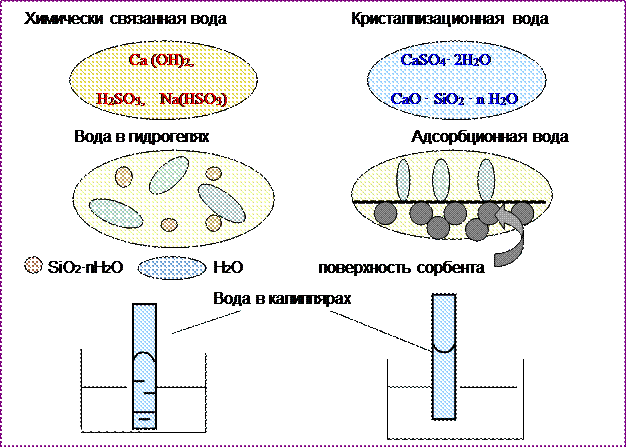
Рис. 3.1 – Формы связанной воды
Знак изменения энтальпии может быть как положительный (растворение сопровождается поглощением теплоты), так и отрицательным (растворение сопровождается выделением теплоты). Растворение кристаллических веществ обычно идёт с поглощением теплоты и сопровождается увеличением энтропии, поэтому их растворению способствуют высокие температуры. Растворение газов ─ процесс экзотермический, идёт с уменьшением энтропии и уменьшается с увеличением температуры (табл. 3.1).
Таблица 3.1
Влияние температуры на растворимость кристаллических веществ и газов
| Агрегатное состояние | Изменение энтальпии | Изменение энтропии | Изменение растворимости при увеличении температуры |
| кристаллы | Δ Н > 0 | Δ S > 0 | увеличивается |
| газы | Δ Н < 0 | Δ S < 0 | уменьшается |
Растворы могут быть ненасыщенными, насыщенными и перенасыщенными (пересыщенными). Насыщенным называется раствор, в котором устанавливается равновесие, когда скорость растворения фазы равна скорости её выделения из раствора:
растворение
Растворяемое вещество (фаза) <==============> Раствор.
образование фазы
Под растворимостью понимают концентрацию насыщенного раствора, её чаще всего выражают массой растворённого вещества, содержащейся в 100 г растворителя. К хорошо растворимым веществам относят те, у которых растворимость 1 г/100 г растворителя, к малорастворимым ─ ( 0,1 … 0,001) г/ 100 г растворителя и к практически нерастворимым < 0,001 г/100 г растворителя.
Существуют более точные способы выражения состава раствора (табл.3.2).
Таблица 3.2
Способы выражения состава раствора
| Наименование | Обозначение | Размерность | Пример формы записи |
| Молярная |
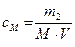
| моль / л | 0,001 M HCl |
| Молярная концентрация эквивалента | 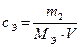
| моль / л | c (½ H2SO4) = 0,1 моль /л |
| Массовая доля | 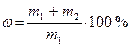
| %, доли единицы | 10 % масс. 0,1 |
| Моляльность | 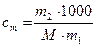
| моль / кг | 1 моль / кг |
| Молярная доля | 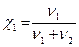
| %, доли единицы | Молярная доля растворённого вещества составляет 20 % |
Условные обозначения:
m1, ν1 − масса (г) и число моль растворителя; m2, ν2 − масса (г) и число моль растворённого вещества; М ─ молярная масса растворённого вещества, г/ моль; V ─ объём раствора; ω, χ − массовая и молярная доля.
Образование растворов всегда сопровождается изменением свойств растворителя и растворяемых веществ. В очень разбавленных растворах частицы растворённого вещества находятся на очень большом расстоянии друг от друга и их взаимное влияние можно исключить, а растворитель практически не меняет своих свойств. Такие растворы по свойствам приближаются к идеальным, и для них условно принято, что
ΔН растворения ≈0 и ΔV растворения ≈ 0.
 |

Дата добавления: 2020-07-18; просмотров: 555;











