Электролитическая диссоциация. Ионно-молекулярные уравнения
Электролитами называют вещества, растворы и расплавы которых про-
водят электрический ток.
К электролитам относятся неорганические кислоты, а также основания, амфотерные гидроксиды и соли. Они распадаются в водных растворах и расплавах на катионы (Кn+) и анионы (Аm-).
Процесс распада молекул электролитов на ионы в среде растворителя получил название электролитической диссоциации (или ионизации).
Для количественной характеристики силы электролита используют понятие степени электролитической диссоциации (ионизации) - α, которая равна отношению числа молекул, распавшихся на ионы (n), к общему числу молекул электролита, введенных в раствор (N):
α = n / N.
Такимобразом, α выражаютв долях единицы.
По степени диссоциации электролиты условно подразделяют на сильные (α » 1) и слабые (α <0,3).
Сильные электролиты
· Соли (средние, кислые, основные): А12(SO4)3, NаHCO3, СuОНСl.
· Неорганические кислоты: НNO3, H2SO4, НС1, НВг, НI, НСlО4. и др.
· Гидроксиды щелочных и щелочноземельных металлов: КОН, NаОН, Са(ОН)2, Ва(ОН)2 и др.
Сильные электролиты диссоциируют в водном растворе практически нацело: А12(SO4)3 = 2А13++3 SO42– NаHCO3 = Nа+ +НСО3–
НNО3 = H++NО3– Н2SO4 = 2Н++SО42–
СuОНСl = CuOH++Cl– Ва(ОН)2 = Ва2++2ОН–
Слабые электролиты
· Почти все органические кислоты: CH3COOH , H2C2O4 и др..
· Некоторые неорганические кислоты: H2CO3, H2S, HCN, H2SiO3, HNO2,
H2SO3 , H3PO4, HClO и др.
· Гидроксиды металлов основного характера (кроме щелочных и щелочноземельных) и гидроксид аммония NH4OH.
· Амфотерные гидроксиды: Al(OH)3, Zn(OH)2 , Cr(OH)3, Sn(OH)2, Pb(OH)2 и др.
Для слабых электролитов диссоциация – обратимый процесс, для которого справедливы общие законы равновесия.
Диссоциацию слабых электролитов характеризует константа равновесия, называемая константой диссоциации (ионизации) КД (табл.П.3):
CH3COOH  CH3COO– + H+
CH3COO– + H+

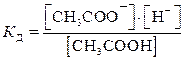
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, и каждую ступень равновесного состояния характеризует своя константа диссоциации (причем Кд1 всегда больше Кд2 и т.д.), например при диссоциации H2S :1-я ступень H2S  H+ + HS–
H+ + HS– 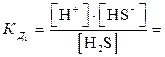 6ּ10-8;
6ּ10-8;
2-я ступень HS– 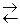 H+ + S2-
H+ + S2- 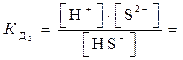 1·10-14,
1·10-14,
где [ ] ─ равновесные концентрации ионов и молекул.
Диссоциация Сu(OH)2:
1-я ступень Сu(OH)2 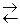 Cu(OH)+ + OH –
Cu(OH)+ + OH –
2-я ступень Cu(OH)+ 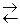 Cu2+ + OH –
Cu2+ + OH –
Амфотерные гидроксиды, напримерPb(OH)2 ,диссоциируют по основному типу: Pb(OH)2 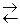 PbOH+ + OH –
PbOH+ + OH –
PbOH+ 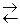 Pb2+ + OH–
Pb2+ + OH–
и кислотному: H2PbO2 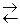 H+ + HPbO2–
H+ + HPbO2–
HPbO2– 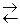 H+ + PbO22 –
H+ + PbO22 –
В растворах электролитов реакции протекают между ионами. Для записи ионных реакций применяют ионные уравнения. При составлении ионных уравнений реакций все слабые электролиты, газы и труднорастворимые электролиты записывают в молекулярной форме, все сильные электролиты (кроме труднорастворимых солей) в ионной форме. Примеры составления ионных уравнений реакций:
· образование труднорастворимых соединений:
Рb(NО3)2 + 2КI = ¯РbI2 + 2КNО3 Рb2+ +2I – = ¯РbI2
· реакции с участием слабодиссоциирующих соединений:
СН3СООNa + НС1 = СН3COOH + NаС1
СН3COO – + Н+ = СН3COOH
НС1 + NаОН = NаС1 + Н2O Н+ + ОН – = Н2O
НС1 + NН4OН = NН4С1+ H2O Н+ + NH4OH =NH4+ + Н2O
СН3COOH +NН4OН = СН3COONH4 + Н2О
СН3COOH + NН4OН = CН3COO – + NH4+ + Н2O
· образование газообразных веществ:
Nа2СО3 + 2НС1 = 2NаС1 + СО2 + Н2О СО32–+ 2Н+ = СO2+ Н2O
Пример 1. Осуществить превращения NаОН ® NаНSО3 ® Nа2SO3 .
Решение.NаОН + Н2SO3 = NаНSO3 + Н2O
ОН– + Н2SO3 = НSО3– +Н2О
NаHSO3 +NаОН = Nа2SO3 + Н2O
НSО3– + ОН – = SO32 – + Н2О
Пример 2.Осуществить превращения Ni(ОН)2 ® (NiOH)2SO4 ® NiSO4.
Решение. 2Ni(ОH)2 + Н2SO4 = (NiOН)2SO4 + Н2O
¯2Ni(ОН)2 + 2Н+ + SO42 – = ¯(NiОН)2SO4 + Н2O
¯(NiОН)2SO4 + Н2SO4 = 2NiSO4 + 2Н2О
¯(NiOН)2SO4 + 2Н+ = 2Ni 2+ + 2SO42– + 2Н2О
Внимание! Основные соли, как правило, нерастворимы в воде, поэтому при написании ионных уравнений их не расписывают на ионы.
Дата добавления: 2016-07-11; просмотров: 2576;











