И растворами щелочей
При взаимодействии металлов с агрессивными средами металл выступает в качестве восстановителя. Химическую активность (восстановительную способность) металла характеризует величина электродного потенциала.
Стандартным электродным потенциалом называют его электродный потенциал, возникающий при погружении металла в раствор собственной соли с концентрацией 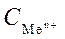 =1 моль/л, измеренный по отношению к стандартному водородному электроду, потенциал которого при 25 0С условно принимается равным нулю.
=1 моль/л, измеренный по отношению к стандартному водородному электроду, потенциал которого при 25 0С условно принимается равным нулю.
Чем меньше значение 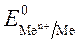 , тем большими восстановительными свойствами обладает данный металл.
, тем большими восстановительными свойствами обладает данный металл.
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов, получаем ряд стандартных окислительно-восстановительных потенциалов металлов (табл. П.6). В этом ряду все металлы условно делят на активные, средней активности и малоактивные:


 Li Rb K Cs Ba Sr Na Mg Be Al Mn Cr Zn Fe Cd Co Ni Sn Pb H2 Bi Cu Hg Ag Pt Au
Li Rb K Cs Ba Sr Na Mg Be Al Mn Cr Zn Fe Cd Co Ni Sn Pb H2 Bi Cu Hg Ag Pt Au
Активные металлы Средней активности Малоактивные
В роли окислителя в растворах кислот, щелочей и в воде выступает среда (потенциалы в табл. П.8). Реакции возможны, если потенциал окислителя больше потенциала восстановителя.
В нейтральной и щелочной среде в роли окислителявыступаетН2О:
2Н2О + 2 ē = Н2 + 2ОН —
В растворах разбавленных кислот (HCl, H2SO4) - окислитель Н+:
2Н + + 2 ē = Н2
В присутствии кислорода процесс восстановления протекает с участием кислорода, так как он обладает бóльшими окислительными свойствами, чемН2О и Н+ : O2 + 4 ē + 4Н + = 2Н2О (в кислой среде);
О2 + 4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах).
В H2SO4 (конц.) и HNO3 (разб.), HNO3 (конц.) окислителем являются анионы кислот. Степень восстановления анионов определяется активностью металла:
H2SO4 (конц.) + Me (активные) ® сульфат Ме + H2S + Н2О
H2SO4 (конц.) + Me (средней активности) ® сульфат Ме +S + Н2О
H2SO4 (конц.) + Me (малоактивные) ® сульфат Ме + SO2+ Н2О
HNO3 (разб.) + Me (активные) ® нитрат Ме + NH4NO3 + Н2О
HNO3 (разб.) + Me (средней активности) ® нитрат Ме +N2, N2O + Н2О
HNO3 (разб.) + Me (малоактивные) ® нитрат Ме + NO + Н2О
HNO3 (конц.) + Me (независимо от активности) ® нитрат Ме + NO2 + Н2О
Внимание!Три распространенных металла – Al, Cr, Fe – на холоде не растворяются в H2SO4(конц.) и HNO3(конц.). В этих кислотах они пассивируются, т. е. покрываются тонкой прочной пленкой, предохраняющей их от разрушения. Реакции протекают только при повышенной температуре.
Дата добавления: 2016-07-11; просмотров: 1831;











