Задания к подразделу 3.2
Задания 121-140. Напишите в молекулярной и ионной формах уравнения возможных реакций предложенных оксидов с H2O, Na2O, KOH, HNO3.
| 121.N2O3; Na2O | 126.SO2; CuO | 131.MnO; P2O5 | 136.N2O5; CuO |
| 122.SnO; P2O5 | 127.Cr2O3; Cl2O7 | 132.BaO; Mn2O7 | 137.P2O5; CoO |
| 123.SO3; CaO | 128.CoO; ZnO | 133.CdO; SnO | 138.PbO; MgO |
| 124.SiO2; NiO | 129.P2O3; FeO | 134.As2O5; CuO | 139.Cl2O7; MnO |
| 125.PbO; N2O5 | 130.Fe2O3; K2O | 135.Al2O3; SiO2 | 140.SO3; TiO |
Задания 141-160. Напишите для предложенных соединений уравнения диссоциации, а также в молекулярной и ионной формах уравнения возможных реакций взаимодействия их с H2SO4 и NaOH.
| 141.HCl; Cr(OH)3 | 151.Ca(OH)2; H3PO4 |
| 142.Cd(OH)2; H2S | 152.HNO3; Be(OH)2 |
| 143.Cu(OH)2; HBr | 153.H2Сr2O7; KOH |
| 144.H2SO3; Sn(OH)2 | 154.HCN; Ga(OH)3 |
| 145.H2SiO3; Pb(OH)2 | 155.KOH; H2CO3 |
| 146.CH3COOH; Fe(OH)3 | 156.HF; Be(OH)2 |
| 147.H2Se; Zn(OH)2 | 157.NH4OH; HClO4 |
| 148.Fe(OH)2; H3AsO3 | 158.Pb(OH)2; HNO2 |
| 149.RbOH; HI | 159.Mg(OH)2; HClO |
| 150.H2Te; Al(OH)3 | 160.Ga(OH)3; HMnO4 |
Задания 161-180. Напишите уравнения диссоциации солей и назовите их.
| 161.ZnCl2, MnOHCl, Ba(HSO3)2 | 171.Pb(HSO4)2, NH4NO3, CoOHCl |
| 162.K2HAsO3, AlOHCl2, Na2SO3 | 172.Al(OH)2NO3, Fe2(SO4)3, KHSe |
| 163.KHSO3, (PbOH)2SO4, CrBr3 | 173.CsHTe, Ca3(PO4)2, MnOHBr |
| 164.Fe(NO3)3, SnOHCl, NaHTe | 174.Mn(NO3)2, Bi(OH)2Cl, KHS |
| 165.NaHSe, CoOHNO3, MgCl2 | 175.Al2(SO4)3, CrOHCl2, KHSO3 |
| 166.CdOHBr, NiCl2, KH2PO4 | 176.NaHSe, NiOHNO3, ZnSO4 |
| 167.CaBr2, (SnOH)2SO4, K2HPO4. | 177.CrOHSO4, BaBr2, CsHSO3 |
| 168.BaCl2, Ca(HCO3)2, AlOHCl2 | 178.Cu(NO3 )2, CoOHCl, NaHS |
| 169.NiBr2, (CoOH)2SO4, KHCO3. | 179.FeCl2, NaH2AsO4, KCrO2 |
| 170.NiOHCl, NiBr2, NaH2PO4 | 180.AlOHBr2, Sr(HS)2, K2SO3 |
Задания 181-200. Напишите в молекулярной и ионной формах уравнения реакций для следующих превращений.
181.Ni(OH)2 (NiOH)2SO4 NiSO4 Ni(OH)2; H3PO4 KH2PO4
182.CuSO4 (CuOH)2SO4 Cu(OH)2 CuOHNO3; NaHSO3 Na2SO3
183.Bi(NO3 )3 BiOH(NO3)2 Bi(OH)3 Bi2O3; Ca3(PO4)2 Ca3(H2PO4)2
184.Co(OH)2 CoOHCl CoCl2 Co(NO3)2; NaOH NaHSO3
185.Pb(NO3 )2 PbOHNO3 Pb(OH)2 K2PbO2; Na2Te NaHTe
186.NiCl2 Ni(OH)2 NiOHCl NiCl2; Ba(HS)2 BaS
187.CrOHCl2 CrCl3 Cr(OH)3 CrOHSO4; H2SiO3 NaHSiO3
188.(SnOH)2SO4 SnSO4 Sn(OH)2 Na2SnO2; K2SO3 KHSO3
189.NiBr2 NiOHBr Ni(OH)2 NiSO4; NaHSiO3 Na2SiO3
190.CoSO4 Co(OH)2 (CoOH)2SO4 Co(NO3)2; H2S Ca(HS)2
191.Cr2(SO4)3 CrOHSO4 Cr2(SO4)3 CrCl3; Mg3(PO4)2 MgHPO4
192.NiSO4 (NiOH)2SO4 Ni(OH)2 NiBr2; NaHCO3 Na2CO3
193.FeOHSO4 Fe2(SO4)3 Fe(OH)3 FeCl3; MgCO3 Mg(HCO3)2
194.Sn(OH)2 SnOHСl K2SnO2 Sn(OH)2; H3AsO4 KH2AsO4
195.NiBr2 Ni(OH)2 NiOHCl NiCl2; BaSO3 Ba(HSO3)2
196.Al(OH)3 Al(OH)2Cl AlCl3 Al(NO3)3; NaH2AsO3 Na3AsO3
197.CoCl2 Co(OH)2 (CoOH)2SO4 CoSO4; H2CO3 NaHCO3
198.Bi(OH)3 Bi(OH)2NO3 Bi(OH)3 Bi2O3; K2HPO4 H3PO4
199.Cu(OH)2 CuOHCl CuCl2 Cu(NO3)2; H2Se KHSe
200.CoSO4 (CoOH)2SO4 Co(OH)2 Co(NO3)2; K2SO3 KHSO3
Гидролиз солей
Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды.
Гидролиз является обратимым процессом. В реакциях гидролиза участву-
ют ионы слабых электролитов: катионы слабых оснований и анионы слабых кислот. Причина гидролиза – образование слабодиссоциированных или труднорастворимых продуктов. Следствием гидролиза является нарушение равновесия в системе H2O 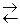 H+ + OH— ; в результате среда становится либо кислой (рН < 7), либо щелочной (pH > 7).
H+ + OH— ; в результате среда становится либо кислой (рН < 7), либо щелочной (pH > 7).
· Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону. Реакция среды щелочная (pH > 7). Первая ступень гидролиза: Na2CO3 + HOH 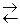 NaHCO3 + NaOH; CO32— + HOH
NaHCO3 + NaOH; CO32— + HOH 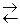 HCO3– + OH—
HCO3– + OH—
· Соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону. Реакция среды кислая (pH < 7).
Первая ступень гидролиза:
Cu(NO3)2 + HOH 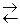 CuOHNO3 + HNO3 Cu2+ + HOH
CuOHNO3 + HNO3 Cu2+ + HOH 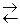 CuOH+ + H+
CuOH+ + H+
· Соль, образованная слабым основанием и слабой кислотой, подвергается гидролизу по катиону и аниону. Характер среды определяется константами диссоциации образовавшихся слабых электролитов.
CH3COONH4 + HOH 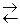 CH3COOH + NH4OH
CH3COOH + NH4OH
CH3COO— + NH4+ + HOH 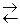 CH3COOH + NH4OH
CH3COOH + NH4OH
· При совместном гидролизе двух солей образуются слабое основание и слабая кислота: 2FeCl3 + 3Na2S +6H2O = 2Fe(OH)3 ¯ + 3H2S + 6NaCl
2Fe3+ + 2S2— + 6H2O = 2Fe(OH)3 ¯ + 3H2S
· Соль, образованная сильной кислотой и сильным основанием, гидролизу
не подвергается, реакция среды нейтральная: KNO3 + HOH ¹
Ионы K+ и NO3— не образуют с водой слабодиссоциирующих продуктов (KOH и HNO3 – сильные электролиты).
Дата добавления: 2016-07-11; просмотров: 2657;











