Химическое равновесие
Состояние системы, при которомскорости прямой и обратной реакции равны, называют химическим равновесием. Состояние равновесия характеризуют константой равновесия (Кс).
Гомогенная система:
2SO2 (г) + O2 (г)  2SO3(г)
2SO3(г) 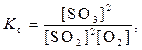
где [ ] – равновесные концентрации веществ.
Гетерогенная система:
Fe2O3 (т) + 3H2 (г)  3 Fe (т) + 3H2O (г)
3 Fe (т) + 3H2O (г) 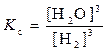 .
.
В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твёрдых веществ остаются, как правило, постоянными.
Принцип Ле Шателье. На состояние равновесия системы влияют давление, концентрация реагирующих веществ и температура. Система может находиться в состоянии равновесия бесконечно долго. Если изменить условия его существования, равновесие будет нарушено. Со временем установится новое состояние равновесия, но с другими равновесными концентрациями. Переход из одного равновесного состояния в другое называют смещением равновесия. Качественно определить направление смещения равновесия позволяет принцип Ле Шателье (1884): если находящаяся в истинном равновесии система подвергается внешнему воздействию, равновесие смещается в направлении, которое способствует ослаблению этого воздействия.
 Пример 1. Для реакции N2 (г) + 3H2 (г)
Пример 1. Для реакции N2 (г) + 3H2 (г)  2NH3 (г) при изменении параметров равновесие смещается: 1) с увеличением
2NH3 (г) при изменении параметров равновесие смещается: 1) с увеличением 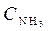
 2) с увеличением Р
2) с увеличением Р
Пример 2. В системе А(г) + 2В(г)  D(г) равновесные концентрации, моль/л: [A] = 0,06; [B] = 0,12; [D] = 0,216. Найти константу равновесия реакции и исходные концентрации веществ А и В.
D(г) равновесные концентрации, моль/л: [A] = 0,06; [B] = 0,12; [D] = 0,216. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение. Константа равновесия данной реакции выражается уравнением
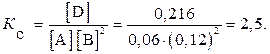
Обозначим исходные концентрации веществ С0, концентрации прореагировавших веществ – Спрор; С0 = Спрор + [ ].
Согласно уравнению реакции
СА прор = [D], СА0 = СА прор + [А] = 0,216 + 0,06 = 0,276 моль/л.
СВ прор =2 [D], СВ0 = СВ прор + [В] =2× 0,216 + 0,12 = 0,552 моль/л.
Дата добавления: 2016-07-11; просмотров: 2216;











