Задания к подразделу 2.1
Вычислить стандартные изменения энтальпии, энтропии, энергии Гиббса в соответствующей реакции ( 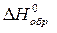 ,
, 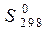 в табл. П.1). Определить температуру, при которой устанавливается химическое равновесие реакции, и сделать вывод о возможности протекания реакции в прямом направлении (из расчетных либо графических данных).
в табл. П.1). Определить температуру, при которой устанавливается химическое равновесие реакции, и сделать вывод о возможности протекания реакции в прямом направлении (из расчетных либо графических данных).
| Номер задания | Уравнение реакции |
| 2Mg(к) + CO2 (г) = 2MgO(к) + C (графит) | |
| 3CH4(г) + CO2(г) + 2H2O(ж) = 4CO(г) + 8H2(г) | |
| 4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г) | |
| 2Н2 S (г) + SO2(г) = 3S (ромб) + 2H2O(ж) | |
| 2Сu2О(т) + Сu2S (т) = 6Сu (к) + SO2(г) | |
| 2H2O (г) + 2Cl2 (г) = 4HCl (г) + O2 (г) | |
| 3Fe2O3(т) + Н2(г) = Н2O(г) + 2Fe3O4(т) | |
| CaO (т) + CO2 (г) = CaCO3 (т) | |
| С (гр.) + СO2( г) = 2СО(г) | |
| 2ZnS(т) + 3О2(г) = 2ZnO(т) + 2SO2(г) | |
| СаСО3(т) = СаО(т) + СО2(г) | |
| ВaO(т) + CO2 (г) = ВaCO3 (т) | |
| 2NO (г) + O2 (г) = 2NO2 (г) | |
| N2O4 (г) = 2NO2 (г) | |
| Al2O3 (т) + 3SO3 (г) = Al2(SO4) 3 (т) | |
| CaO (т) + Н2O (ж) = Ca(ОН)2 (т) | |
| FeO(т)+ H2(г ) = Fe(т) +Н2О(г) | |
| CuO(т) + C(т) = Cu(к) + CO(г) | |
| CaO (т) +Fе2O3(т) = Ca(FеO2)2(т) | |
| CaO (т) + SO3 (г) = CaSO4 (т) |
Скорость химических процессов
Для полного описания химической реакции необходимо знать не только принципиальную возможность ее осуществления (решается термодинамически), но и закономерности протекания во времени, т.е. ее скорость и механизм.
Химические реакции могут проходить в гомогенных и гетерогенных системах. Гомогенной называют систему, однородную по составу и свойствам. Гетерогенной называют систему, состоящую из двух или более однородных частей, отделенных друг от друга поверхностью раздела.
Скорость гомогенной химической реакции определяется изменением кон-центрации одного из исходных веществ или продуктов реакции в единицу времени при неизменном объеме системы.
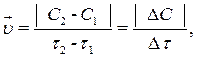
где 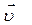 – скорость химической реакции, моль/(л×с); C1 – первоначальная концентрация вещества (в момент времени τ1), моль/л; C2 – концентрация вещества в момент времени τ2 > τ1, моль/л; ΔС – изменение концентрации вещества за время Δτ = τ2 – τ1; τ1,– исходный момент времени, с; τ2 – текущий момент времени, с; (τ2 > τ1).
– скорость химической реакции, моль/(л×с); C1 – первоначальная концентрация вещества (в момент времени τ1), моль/л; C2 – концентрация вещества в момент времени τ2 > τ1, моль/л; ΔС – изменение концентрации вещества за время Δτ = τ2 – τ1; τ1,– исходный момент времени, с; τ2 – текущий момент времени, с; (τ2 > τ1).
В гетерогенных системах реакции идут на поверхности раздела отдель- ных частей системы. Скорость гетерогенной реакции определяют изменением количества вещества, вступившего в реакцию или образующегося в реакции в единицу времени на единице поверхности.
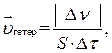
где 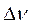 – изменение количества вещества, моль за промежуток времени Δτ, с;
– изменение количества вещества, моль за промежуток времени Δτ, с;
S – площадь поверхности раздела, м2.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации, температуры, присутствия катализаторов.
Дата добавления: 2016-07-11; просмотров: 2163;











