Термодинамический метод рассмотрения химических процессов
Термодинамический подход заключается в рассмотрении начального и конечного состояний взаимодействующих веществ, при этом не учитываются механизм и скорость процесса.
Для описания систем используют набор термодинамических функций, основными из которых являются Н – энтальпия, S – энтропия, G – энергия Гиббса. В справочных таблицах приводят стандартные: энтальпии образования веществ 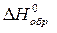 , кДж/моль, энтропии веществ
, кДж/моль, энтропии веществ 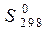 , Дж/(моль×К) (табл. П.1), энергии Гиббса образования веществ
, Дж/(моль×К) (табл. П.1), энергии Гиббса образования веществ 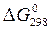 , кДж/моль. Стандартные условия:
, кДж/моль. Стандартные условия:
Т = 298 К; Р = 1,013×105 Па; вещества –химически чистые.
Энтальпийный эффект химической реакции определяют по закону Гесса и
следствию из него. Следствие из закона Гесса: изменение энтальпии химической реакции равно разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрическихкоэффициентов:
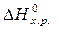 = å(n
= å(n 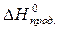 ) – å (m
) – å (m 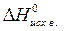 ),
),
где n, m – стехиометрические коэффициенты.
Аналогичным образом можно рассчитывать изменение и других функций – энтропии ( 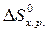 ), энергии Гиббса (
), энергии Гиббса ( 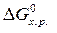 ).
).
В системах, находящихся при постоянных температуре и давлении, самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением энергии Гиббса (DG < 0). Если DG > 0 , реакция протекает в обратном направлении, а при DG = 0 система находится в состоянии химического равновесия.
Пример. Вычислить стандартные изменения энтальпии, энтропии, энергии Гиббса в реакции CO2(г) + С (графит) = 2CO(г). Определить температуру, при которой устанавливается химическое равновесие реакции, и сделать вывод о возможности протекания реакции в прямом направлении.
Решение.
· Рассчитать стандартное изменение энтальпии реакции:
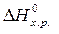 = å (n
= å (n 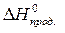 ) – å (m
) – å (m 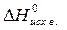 )= 2
)= 2 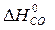 – (
– (  +
+ 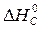 )=
)=
= 2×(–110,5) – (–393,5 + 0) = 172,5 кДж.
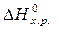 >0 – эндотермическая реакция.
>0 – эндотермическая реакция.
· Рассчитать стандартное изменение энтропии реакции:
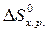 = å (n
= å (n 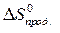 ) – å (m
) – å (m 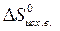 )=
)= 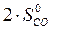 – (
– ( 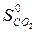 +
+ 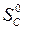 ) =
) =
=2·197,5 – (213,7 + 5,7) = 175,6 Дж/К = 175,6×10-3 кДж/К.
· Рассчитать стандартное изменение энергии Гиббса реакции:
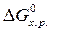 =
= 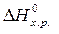 –
– 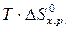 = 172,5 –298×175,6×10-3 = 120,2 кДж.
= 172,5 –298×175,6×10-3 = 120,2 кДж.
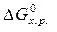 > 0, при Т = 298 К прямая реакция невозможна.
> 0, при Т = 298 К прямая реакция невозможна.
· Определить температуру, при которой устанавливается химическое равновесие.
Если пренебречь зависимостями 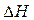 и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS »
и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS » 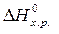 –
– 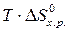
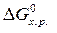 =
= 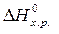 –
– 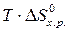 = 0 Þ Т =
= 0 Þ Т = 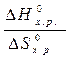 =
= 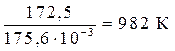
· Построить график зависимости 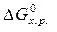 от Т.
от Т.
 |
Из графика видно, что в интервале температур 0 – 982 К DG > 0, следовательно, прямая реакция невозможна; выше 982 К DG < 0, т.е. самопроизвольно протекает прямая реакция.
Дата добавления: 2016-07-11; просмотров: 2910;











