Свободная и связанная вода в растворах
В растворах полимеров какая-то часть растворителя оказывается прочно связанной с макромолекулами вследствие протекания процессов сольватации и вместе с ними участвует в броуновском движении. Другая же его часть играет роль среды, в которой находятся частички дисперсной фазы.
В связи с этим в набухших полимерах и растворах ВМС различают 2 вида воды: связанную (или гидратационную) и свободную (или капиллярную). Количество связанной воды напрямую зависит от гидрофильности полимера. Чем она выше, тем содержание такой воды больше.
Многочисленные исследования показали, что свойства связанной воды довольно резко отличаются от свойств свободной воды. Первая имеет более упорядоченную структуру и, соответственно, большую плотность, чем вторая. Так плотность связанной воды на поверхности набухшего крахмала колеблется в пределах 1,28-2,45 г/см3.
Диэлектрическая постоянная такой воды равна 2,2 вместо 81. В связи с этим гидратные оболочки высокомолекулярных соединений не обладают хорошими растворяющими свойствами, поэтому электролиты и полимеры способны растворяться только в свободной воде.
Упорядоченность молекул воды в гидратных оболочках, ее уплотненность обусловливает еще одно важное свойство связанной воды: при охлаждении растворов ВМС она не замерзает, тогда как свободная вода делает это в первую очередь. Кровь, протоплазма животных и растительных клеток представляет собой сложнейшую систему, состоящую из растворенных и набухших высокомолекулярных соединений, поэтому вполне понятно то огромное значение, которое играет свободная вода в живой клетке.
Ранее полагали, что растения погибают от пониженных температур в результате механических повреждений клеточных мембран кристаллами образующегося льда. Однако последующие исследования показали, что механизм действия низких температур на растения и все живое гораздо сложнее. Понижение температуры губительно не само по себе, а в результате обезвоживающего действия при вымораживании воды. Микроскопические исследования установили, что на первой стадии замерзания кристаллы льда образуются не внутри клеток, а в межклеточных пространствах, где содержание свободной воды гораздо больше чем внутри клетки. Это приводит к тому, что по законам осмоса свободная внутриклеточная вода диффундирует в тканевую жидкость. Протоплазма самой клетки при этом обезвоживается (сжимается), в ней резко возрастает концентрация растворенных электролитов, белков. Это, в свою очередь, вызывает необратимую коагуляцию в цитоплазме клетки.
Связанная вода в значительной мере лишена той подвижности, которая свойственна обычной воде. Многие белковые студни при содержании ничтожно малого количества сухого вещества имеют полутвердый характер и обладают способностью сохранять свою форму. Так медузы, тело которых содержит всего лишь 1% сухого вещества и 99% воды по массе, тем не менее сохраняют и форму и достаточную жизненную стойкость.
Считается установленным, что одна из причин старения организма заключается в потере способности его тканей удерживать связанную воду на нормальном уровне. Как правило, молодые организмы содержат значительно больше связанной воды, чем старые.
Полиэлектролиты
Многие природные и синтетические полимеры содержат в составе элементарных звеньев своих макро молекул различные ионогенные функциональные группы, способные диссоциировать в водных растворах. Такие вещества называются высокомолекулярными электролитами, или полиэлектролитами. При их диссоциации образуются небольшие подвижные ионы и многозарядный полимерный макроион. По характеру диссоциации ионогенных групп полиэлектролиты можно разбить на следующие 3 вида.
1. Полиэлектролиты, содержащие в своем составе только кислотные группы, диссоциирующие с отщеплением иона Н+, например –COOH, –SO3H, –SH. Из природных полимеров к таким полиэлектролитам относятся агар, окисленный крахмал, пектин. В состав макромолекул агара входят сульфогруппы, а элементарные звенья окисленного крахмала и пектина содержат карбоксильные группы. В некоторых полимерах ион водорода в этих группах может быть замещен на катион металла.
2. Полиэлектролиты, макромолекулы которых содержат тольео основные группы, например аминогруппу –NH2. Среди биополимеров таких соединений нет. Данные полиэлектролиты получают синтетическим путем. К ним относятся многие анионообменные смолы (аниониты), имеющие большое практическое значение.
3. Полиэлектролиты, в макромолекулах которых чередуются кислотные и основные группы.Такие полиэлектролиты можно назвать полимерными амфотерными электролитами, или полиамфолитами.К ним относятся самый сложный и самый важный для живых организмов класс полимеров – белки.
Наличие в макромолекулах белков двух свободных ионогенных групп: основной –NH2 и кислотной –COOH – придает им амфотерные свойства. В водных растворах белок может диссоциировать и как кислота и как основание:
Pt–COOH ↔ Pt–COO– + H+
Pt–NH2 + HOH ↔ Pt–NH3+ + OH–
В кислой среде, содержащей избыток ионов Н+ ионизация СООН-групп будет подавлена и макромолекула белка приобретет положительный заряд за счет ионизации амино-групп.
В щелочной среде, наоборот, будет подавляться процесс протонирования NH2-групп, зато практически полностью продиссоциируют СООН-группы. Белок будет вести себя как кислота и его молекулы приобретут отрицательный заряд.
Очевидно, должна существовать такая концентрация ионов Н+ в растворе, при которой число ионизированных кислотных групп в молекуле белка будет равно числу ионизированных основных групп. Суммарный же электрический заряд такой макромолекулы станет равным нулю. Данное состояние белка в водном растворе называется изоэлектрическим состоянием, а значение рН раствора при котором молекула белка находится в изоэлектрическом состоянии его изоэлектрической точкой (I).
Большинство природных белков содержит в пептидной цепи значительные количества остатков дикарбоновых аминокислот (аспарагиновой, глутаминовой). Такие белки называются кислотными. Изоэлектрическая точка кислотных белков лежит в области рН < 7. Для ее достижения в раствор белка нужно ввести некоторое количество сильной кислоты, чтобы подавить диссоциацию части карбоксильных групп.
Нейтральные белки содержат в своих макромолекулах примерно равное количество кислотных и основных групп. Они переходят в изоэлектрическое состояние непосредственно в ходе своего растворения и не требуют для этого добавления сильной кислоты либо щелочи. Для них I ≈ 7.
В молекулах оснóвных белков NH2-групп содержится больше чем кислотных. Для перевода их в изоэлектрическое состояние в раствор нужно добавить какое-то количество щелочи, чтобы депротонировать избыточные оснóвные группы. Соответственно электрическая точка основных белков лежит в области рН > 7.
От реакции среды и характера диссоциации белковой молекулы зависит ее форма в растворе. При диссоциации ионогенных групп только по кислотному или только по основному типу в изогнутой спиралью пептидной цепи появятся одноименные заряды, распределенные по всей ее длине. За счет возникающих электростатических сил расталкивания соседние витки спирали будут стремится удалиться друг от друга. В результате этого макромолекула будет растягиваться.
В изоэлектрическом состоянии вдоль пептидной цепи чередуются заряды противоположного знака, способствующие сжатию молекулы или даже скручиванию ее в глобулу (рис. 79б).
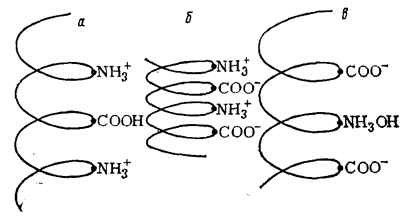
Рис. 79. Форма макромолекулы белка в кислой среде (а), в изоэлектрической точке (б) и в щелочной среде (в)
Таким образом, в изоэлектрическом состоянии молекулы белка в растворе занимают наименьший объем. С увеличением или уменьшением рН молекулы распрямляются.
Объем макромолекул белков влияет на вязкость их растворов. В изоэлектрическом состоянии она должна быть минимальной (рис. 80). На этом свойстве растворов белков основан один из способов определения их изоэлектрической точки. Ее опытным путем можно определить еще и электрофоретическим методом. Аналогично изменению вязкости в зависимости от рН раствора протекает и процесс набухания белков. В изоэлектрической точке степень набухания белка минимальна.
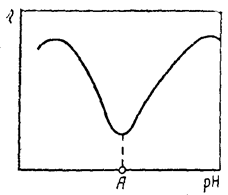
Рис. 80. Зависимость вязкости раствора белка от рН среды: А – изоэлектрическая точка белка
Дата добавления: 2020-07-18; просмотров: 864;











