Плавление и отвердевание
1. Плавление. Теплота плавления. Плавление – переход вещества из твердого кристаллического состояния в жидкое. Главными характеристиками плавления чистых веществ являются теплота плавления и температура (точка) плавления.
Теплота плавления – это энергия, необходимая для разрушения кристаллической решетки тела при температуре плавления. Теплота плавления, отнесенная к единице массы, называется удельной. Она обозначается 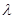 и измеряется в Джçкг. Теплота плавления на 1 моль, называется молярной. Она обозначается
и измеряется в Джçкг. Теплота плавления на 1 моль, называется молярной. Она обозначается 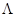 и измеряется в Джçмоль. В таблице 27 приведены значения
и измеряется в Джçмоль. В таблице 27 приведены значения 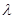 и
и 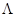 при температурах плавления под атмосферным давлением.
при температурах плавления под атмосферным давлением.
| ратм = 1,01×105 Па | Таблица 27 | ||||||
| Вещество | 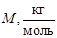
| 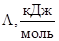
| 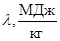
| Вещество | 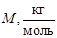
| 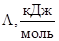
| 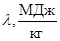
|
| Алюминий | 0,027 | 10,6 | 0,393 | Золото | 0,197 | 13,2 | 0,067 |
| Висмут | 0,209 | 10,5 | 0,050 | Медь | 0,064 | 13,6 | 0,213 |
| Вода (лед) | 0,018 | 6,0 | 0,332 | Олово | 0,119 | 6,9 | 0,058 |
| Вольфрам | 0,184 | 34,0 | 0,185 | Ртуть | 0,201 | 2,4 | 0,012 |
| Железо | 0,056 | 15,1 | 0,270 | Свинец | 0,207 | 5,0 | 0,024 |
2.  Температура плавления. Зависимость температуры плавления от давления также определяется уравнением Клапейрона – Клаузиуса.
Температура плавления. Зависимость температуры плавления от давления также определяется уравнением Клапейрона – Клаузиуса. 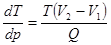 , (26.1)
, (26.1)
где V1 – объем твердого тела, V2 – объем жидкости. У большинства простых веществ объем при плавлении увеличивается, поэтому отношение dTçdp > 0. С ростом внешнего давления температура плавления этих веществ растет (кривая 1 на рис.108). Так, ртуть, например, при р =104 атмосфер плавится при +12°С вместо -39°С. Но есть вещества, у которых объем при плавлении уменьшается. Это висмут Bi, галлий Ga, германий Ge, кремний Si, плутоний Pu, сурьма Sb, и соединения: Н2О, GaSb, InSb. У них с ростом внешнего давления температура плавления понижается (кривая 2 на рис.108). Так, у льда при повышении давления до 2000 атмосфер температура плавления понижается до -20°С.
Если при давлении р в пределах от ртр до ркр нагревать вещество дальше, то при пересечении кривой 3 жидкость закипит. Жидкая фаза перейдет в паровую.
3.  Диаграмма плавления – это кривая, иллюстрирующая зависимость температуры Т от времени
Диаграмма плавления – это кривая, иллюстрирующая зависимость температуры Т от времени 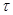 при нагревании.
при нагревании.
На рис.109 показана диаграмма плавления олова Sn (линия 1). Характерным для диаграмм плавления кристаллических веществ является наличие горизонтального участка изотермы. В начале изотермы в момент времени tн начинается плавление, в конце в момент времени tк заканчивается. После этого идет нагрев жидкости.
Если нагреватель имеет постоянную во времени тепловую мощность q, то длина участка плавления Dtпл = tк - tн однозначно связана с углами наклона участков нагревания вещества в твердом (0®tн ) и в жидком состояниях (tн ®).
Например, при нагревании твердого тела массой m, имеющего удельную теплоемкость cт, справедливо равенство: q×Dtт = ст×m×Dt. (26.2)
Здесь Dtт - время нагревания твердого тела, Dt - повышение температуры за это время. Отсюда выразим угловой коэффициент Кт участка нагревания тела. 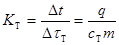 . (26.3)
. (26.3)
В процессе плавления должно выполнятся условие: qDtпл = lm. (26.4)
Перемножив (26.3) и (26.4), получаем: Dtпл = lçстKт, или l = стKтDtпл, (26.5)
У большинства веществ теплоемкость в твердом и жидком состояниях разная. Поэтому отличаются и углы наклона соответствующих участков. У олова (рис.109) удельная теплоемкость при плавлении практически не меняется и составляет 243 Дж/кг.
Кривая 2 (штриховая линия) на рис.109 показывает изменение температуры аморфных тел (лабораторное стекло, с = 840 Дж/кг). В отличие от кристаллических аморфные тела не имеют точек плавления, их кривые нагревания не имеют горизонтальных плато. С повышением температуры вязкость аморфных тел постепенно уменьшается.
4. Диаграмма кристаллизации вещества из жидкого состояния зеркально симметрична диаграмме плавления (рис.110). Если от вещества отнимается ежесекундно то же количество тепла q, что и сообщалось при плавлении, диаграмма повторяет диаграмму плавления в обратном направлении во всех деталях, за исключением начала кристаллизации. Здесь для запуска процесса кристаллизации температура на какое-то время делается ниже точки кристаллизации. Когда кристалл нагревается до температуры плавления, он начинает немедленно плавиться. Невозможно реализовать состояние перегретого кристалла, температура которого была бы выше точки плавления.  А вот при охлаждении может реализоваться состояние переохлажденной жидкости, температура которой ниже точки кристаллизации. Это метастабильное состояние. Оно возникает тогда, когда в жидкости нет центров кристаллизации. Так, например, тщательно очищенную воду можно охладить без сотрясения до температуры -10°С. Но если в такую воду бросить кристаллики льда или просто встряхнуть сосуд, то вода быстро затвердевает, причем температура резко поднимается до 0°С.
А вот при охлаждении может реализоваться состояние переохлажденной жидкости, температура которой ниже точки кристаллизации. Это метастабильное состояние. Оно возникает тогда, когда в жидкости нет центров кристаллизации. Так, например, тщательно очищенную воду можно охладить без сотрясения до температуры -10°С. Но если в такую воду бросить кристаллики льда или просто встряхнуть сосуд, то вода быстро затвердевает, причем температура резко поднимается до 0°С.
Если температура затвердевшей жидкости понижается при естественном остывании, то по мере приближения ее к температуре окружающей среды ежесекундные потери тепла становятся все меньше. Поэтому кривая температуры приближается к экспоненте.
Чтобы молекулы жидкости могли образовать кристаллическую решетку, они должны иметь возможность перемешаться –двигаться в каком-то направлении, менять ориентацию. Поэтому скорость кристаллизации переохлажденной жидкости даже при наличии зародышей сильно зависит от вязкости жидкости, которая тем больше, чем ниже температура жидкости.
В вязких жидкостях при больших переохлаждениях скорость кристаллизации может сделаться практически равной нулю. Вещество твердеет, приобретает отличный от нуля модуль сдвига, а с точки зрения молекулярной структуры по-прежнему остается жидкостью.
К таким переохлажденным жидкостям относятся, например, стекло, плавленый кварц, плавленый сахар, битумы, твердые полимеры. В отличие от кристаллических эти твердые вещества называются аморфными.
5. Моно- и поликристаллы. Если число зародышей в жидкости невелико и они находятся далеко друг от друга, то на каждом из зародышей может сформироваться монокристалл, имеющий непрерывную кристаллическую решетку и четко выраженную анизотропию свойств. Если процесс кристаллизации происходит медленно в равновесных условиях, то монокристаллы приобретают естественную огранку, обусловленную его атомно-кристаллической структурой. В природе встречаются монокристаллы кварца, каменной соли, исландского шпата, алмаза и др.
Многие монокристаллы обладают ценными свойствами, поэтому изделия из них находят широкое применение. Например, алмаз предельно тверд, флюорит (CaF2) прозрачен для широкого диапазона длин волн, кварц – пьезоэлектрик. Наряду с природными все шире применяются монокристаллы, полученные промышленными методами: полупроводниковые, оптические (рубина, флюорита, фтористого лития), тугоплавкие (шпинеля, рутила) и др.
В обычных условиях число зародышей в кристаллизующейся жидкости велико, поэтому образуется поликристалл – агрегат из множества мелких монокристаллов. Если на процесс кристаллизации не накладывалось внешнее воздействие, то все кристаллические зерна ориентируются беспорядочно. В результате поликристалл изотропен, его свойства одинаковы по всем направлениям. Поликристаллами являются металлы, сплавы, минералы, керамики.
Наличие границ зерен влияет на физические свойства поликристаллов. По сравнению с монокристаллами уменьшается предел прозрачности, увеличивается электрическое сопротивление и т.д.
6. Диаграммы равновесия. Тройная точка. При любых давлении и температуре пар и твердое тело могут находиться в динамическом равновесии, как пар и жидкость. Давление насыщенного пара над твердым телом быстро уменьшается с понижением температуры, так что у многих твердых тел, например, у металлов, керамик, минералов, упругость насыщенных паров при обычных температурах ничтожно мала.
 Теоретически пары любого простого вещества могут существовать при всех температурах вплоть до абсолютного нуля. С ростом температуры равновесное давление паров над твердым телом повышается. При достижении некоторой температуры Ттр твердое тело будет к тому же плавиться. Поэтому в этой точке все три фазы – твердая, жидкая и газообразная – находятся в равновесии и при сохранении Ттр и давления ртр постоянными могут существовать сколь угодно долго. Это состояние на диаграмме равновесия называют тройной точкой.
Теоретически пары любого простого вещества могут существовать при всех температурах вплоть до абсолютного нуля. С ростом температуры равновесное давление паров над твердым телом повышается. При достижении некоторой температуры Ттр твердое тело будет к тому же плавиться. Поэтому в этой точке все три фазы – твердая, жидкая и газообразная – находятся в равновесии и при сохранении Ттр и давления ртр постоянными могут существовать сколь угодно долго. Это состояние на диаграмме равновесия называют тройной точкой.
С ростом температуры выше Ттр кривая равновесия раздваивается (рис.111). При одной и той же температуре может быть равновесие между жидкостью и паром, а при большем давлении – между жидкостью и твердым телом. Все три кривые делят плоскость Р, Т на три области: 1 – пар, 2 – жидкость, 3 – твердое тело.
Кривая равновесия 1 – 2 называется кривой испарения, 2 – 3 кривой плавления,
1 – 3 кривой возгонки. Штриховой линией показана кривая плавления веществ, объем которых при плавлении уменьшается (H2O, Bi, Ga, Ge, Si, Pu, Sb, GaSb, InSb).
Кривая возгонки ограничена по температуре точками О и Ттр. Кривая испарения ограничена точками Ттр и Ткр. Кривая плавления ограничена только снизу точкой Ттр. Опыт не позволяет пока установить верхнюю границу этой кривой.
У воды температура в тройной точке на 0,01 К выше температуры плавления при нормальных условиях и составляет Ттр = 273,16 К, давление ртр = 609 Па (4,6 мм рт. ст.). Температуры тройных точек некоторых веществ используются в качестве реперных при построении термометрических шкал. В таблице 27 приведены значения температуры и давления в тройной точке для некоторых веществ.
| Таблица 27 | ||||
| Вещество | Температура тройной точки | Давление насыщенного пара в тройной точке | ||
| К | °С | Па | атм | |
| Аммиак NH3 | 195,42 | -77,73 | 0,060 | |
| Ацетон CH3COCH3 | 178,9 | -94,3 | 2,1 | 2,2×10-6 |
| Вода H2O | 273,16 | 0,01 | 6,02×10-3 | |
| Метан СН4 | 90,66 | -182,49 | 0,115 | |
| Оксид углерода СО2 | 216,55 | -56,60 | 51,7×104 | 5,11 |
| Эфир этиловый (СН3СН2)2СО | 152,9 | -110,3 | 0,83 | 8,5×10-6 |
Как видно из диаграммы равновесия (рис.111), вещество может переходить в пар как из жидкого состояния, так и из твердого. Это зависит от давления и температуры. Если давление меньше ртр, то вещество, будучи даже в жидком состоянии, бурно испаряясь даже при недостатке тепла, остывает и кристаллизуется. Испарение переходит в возгонку.
Так, например, у углекислоты Ттр = -56,6°С, а ртр = 5,1 атм. Поэтому при атмосферном давлении углекислота находится только в твердом состоянии.
Тело может перейти из твердого в газообразное состояние как возгонкой, так и последовательно плавлением и испарением. Но теплота фазового перехода одна и та же (при одной и той же температуре). d = l +r, D = L + Â (26.6)
Дата добавления: 2020-05-20; просмотров: 1077;











