Глава 6. Фазовые переходы
Агрегатные состояния и фазы. Уравнение Клапейрона-Клаузиуса
1. Агрегатные состояния вещества (от латинского aggrego – присоединяю) – это состояние одного и того же вещества в различных интервалах температур и давлений. Их 3: твёрдое, жидкое, газообразное.
Все простые химические вещества (элементы) в зависимости от температуры и давления могут находиться в любом из 3-х агрегатных состояний. В каждом температурном диапазоне реализуются разные комбинации (рис.91).
| Твердое (основное) + газообразное + жидкое (метастабильное) | Жидкое (основное) + газообразное | Газообразное (основное) + жидкое (метастабильное) | ||||

| ||||||
0 Тпл ТкипТ, К
Рис.91
Здесь Тпл и Ткип – температуры плавления и кипения вещества при данном постоянном давлении. При температуре выше критической Ткр реализуется только одно газообразное агрегатное состояние.
 |
2. Фаза (от греческого phasis – появление) – это широкое понятие. Фазой называют макроскопическую физически однородную часть вещества, отделённую от остальных частей системы границами раздела. Фаза может быть извлечена из системы механически. Могут быть однофазные, двухфазные и многофазные системы (рис.92).
На рис.92-а в системе одна газообразная фаза – пары воды. На рис.92-б – две фазы – жидкая (вода) и газообразная (пар). В третьей системе 92-в три фазы: газообразная (пар), жидкая (вода), твёрдая (лёд). Поскольку число возможных фаз у воды исчерпано, то дальнейший рост числа фаз в системе может происходить лишь за счет привлечения других веществ. На рис.92-г в системе 4 фазы: одна газообразная (пар), две жидкие (вода и капля ртути), одна твердая (лед). На рис.92-д показана 5-фазная система: одна газообразная (пар), две жидких (вода и ртуть), две твердых (лед и железо).
В одной системе могут быть сколько угодно твердых и жидких фаз, но только одна газообразная. Дело в том, что газы растворяются друг в друге неограниченно.
Если все фазы системы имеют одну и ту же температуру, то говорят, что система находится в тепловом равновесии.
3. Фазовый переход – это переход вещества в системе из одного фазового состояния в другое. Различают фазовые переходы 1-го рода (ФП-1) и 2-го рода (ФП-2).
ФП-1 сопровождаются скачкообразным изменением внутренней энергии или других связанных с ней величин – плотности, теплоёмкости. Все ФП-1 происходят при определённых температуре и давлении и сопровождаются поглощением либо выделением энергии.
ФП-2 не связаны с выделением или поглощением тела. Они сопровождаются скачкообразными изменениями одной или нескольких из следующих 3-х величин: а. Теплоёмкости C = dU/dT; б. Коэффициента теплового расширения a = (1/V)×( dV/dT)p; в. Изотермического коэффициента сжимаемости вещества c = (1/V)×( dV/dp)T.
К фазовым переходам 2-го рода, относятся, например, переход ферромагнетика (Fe, Ni, Co, сплавы, керамики) в парамагнитное состояние, превращение сегнетоэлектриков (BaTiO3, KNaC4H4O6×2H2O, LiNiO, … всего несколько сотен) в неполяризованные диэлектрики и др.. Температура ТС , при которой происходит ФП-2, называется точкой Кюри.
4. Фазовые переходы 1-го рода. К ним относятся все изменения агрегатного состояния вещества, то есть переходы: твёрдое состояние ↔ жидкое состояние, жидкость↔газ, твёрдое состояние↔газообразное состояние.
Переход из твёрдого состояния в жидкость называют плавлением, из жидкого в газообразное – испарением. Переход из твёрдого состояния в газообразное называют сублимацией(от лат. Sublimo - возношу) или возгонкой. Все перечисленные здесь переходы происходят с поглощением тепла. Обратные переходы сопровождаются выделением тепла. Переход в твёрдое состояние из жидкого или газообразного называют кристаллизацией, переход в жидкое из газообразного – конденсацией.
ФП-1 твёрдое тело ↔ жидкость характеризуется при определённом давлении температурной точкой плавления-кристаллизации Тпл = Ткрист, молярной Λ и удельной λ теплотой плавления-кристаллизации.
Переход жидкость↔газ при определённом давлении характеризуется точкой кипения-росы Ткип = Тросы , молярной Â и удельной r теплотой испарения-конденсации.
 |
Переход твёрдое тело-газ не имеет фиксированной температурной точки фазового перехода. Но при определённой температуре он характеризуется молярной D и удельной d теплотой возгонки-кристаллизации.
При фазовых переходах первого рода скачком изменяется внутренняя энергия вещества U (рис.93) и его теплоёмкость Cp (рис.94).Как видно из рис.93, график внутренней энергии U, построенный для 1 моля воды H2O, в точках фазового перехода первого рода испытывает разрыв. В точке плавления Тпл внутренняя энергия увеличивается на теплоту плавления, а в точке кипения – на теплоту испарения. Поскольку при плавлении и испарении скачком меняется и теплоёмкость (рис.94), то на графике U(T) на рис.93 скачком меняется также и угол наклона соответствующих участков кривой.
При переходах 1-го рода новая фаза не возникает сразу во всём объёме. Сначала образуются зародыши новой фазы, которые затем растут и распространяются на весь объём.
5. Уравнение Клапейрона-Клаузиуса является теоретической основой для прогнозирования поведения систем в фазовых переходах 1-го рода.
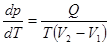 . Б. Клапейрон, 1834, Р. Клаузиус, 1851 (23.1)
. Б. Клапейрон, 1834, Р. Клаузиус, 1851 (23.1)
Здесь p – давление, T – температура, при которых происходит фазовый переход, Q – теплота фазового перехода, V1 и V2 – начальный и конечный объём вещества.
 Рассмотрим вывод этого уравнения методом циклов на примере фазового перехода испарение - конденсация. Проведём мысленно цикл Карно с некоторым количеством вещества n так, чтобы в процессе цикла вещество проходило через разные фазовые состояния.
Рассмотрим вывод этого уравнения методом циклов на примере фазового перехода испарение - конденсация. Проведём мысленно цикл Карно с некоторым количеством вещества n так, чтобы в процессе цикла вещество проходило через разные фазовые состояния.
Состояние 1. Пусть в цилиндре под поршнем при температуре T и под давлением p находится n молей жидкости, объём которых в исходном жидком состоянии V1 (рис.95).
Проведём изотермическое расширение системы при T = const. Это возможно лишь при условии, что жидкость будет испаряться. Чтобы температура оставалась постоянной, к жидкости нужно подводить тепло. Когда жидкость получит количество теплоты Q, равное теплоте испарения при температуре T, вся жидкость перейдет в газообразное состояние 2 с параметрами p, T, V2 (рис.96).
Состояние 2. Из состояния 2 будем адиабатно расширять пар так, чтобы объем увеличился на величину dV. В конце расширения объем системы стал V2+dV. Одновременно понижаются температура и давление, так что в конце адиабатного расширения система переходит в состояние 3 с параметрами p - dp, T - dT, V2 + dV (рис.97).
Состояние 3. При температуре T - dT изотермически сжимаем пар при постоянном давлении p - dp. Чтобы поддержать постоянство температуры, нужно отводить тепло от системы. Когда количество отведенного тепла будет равным теплоте конденсации Q - dQ при температуре T - dT, весь пар сконденсируется в жидкость с параметрами T - dT, p-dp, V1+dV. Система переходит в состояние 4 (рис.98).
 Состояние 4. Чтобы вернуть систему в исходное состояние и замкнуть цикл, адиабатно сожмем жидкость на величину объема dV. В результате объем жидкости уменьшится до первоначальной величины V1, а температура и давление повысится до величин T и p.
Состояние 4. Чтобы вернуть систему в исходное состояние и замкнуть цикл, адиабатно сожмем жидкость на величину объема dV. В результате объем жидкости уменьшится до первоначальной величины V1, а температура и давление повысится до величин T и p.
Найдем КПД цикла. 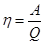 . (23.2)
. (23.2)
В системе координат p, V график цикла имеет форму бесконечно тонкого горизонтального четырехугольника (рис.99). Адиабаты 2®3 и 4®1, строго говоря, разные. В процессе 2®3 расширяется газ, а в процессе 4®1 сжимается жидкость. Однако поскольку четырехугольник бесконечно тонкий, разница в работах dA2®3 и dA4®1 есть величина 2-го порядка малости. Это позволяет считать работу цикла равной алгебраической сумме работ изотермических
процессов. dA = A1®2+ A3®4= p(V2– V1)+(p – dp)(V1– V2)=(V2– V1)dp. (23.3)
Теперь КПД идеального цикла Карно можно представить двумя способами:
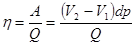 и
и 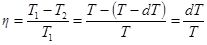 (23.4)
(23.4)
Приравняв правые части этих выражений, получим 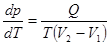 . (23.5)
. (23.5)
Примерно так это уравнение получил в 1834 г. Бенуа Клапейрон, а в 1851 г. Рудольф Клаузиус распространил его на все фазовые переходы 1-го рода.
Если в правой части уравнения разделить числитель и знаменатель на массу вещества m, то получаем уравнение в удельных величинах. 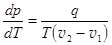 . (23.6)
. (23.6)
Здесь q – удельная теплота фазового перехода, v1 и v2 – удельные объемы вещества.
Дата добавления: 2020-05-20; просмотров: 1158;











