Испарение и конденсация
8. Испарение – переход вещества из жидкого состояния в газообразное. При испарении поглощается энергия, т.к. каждая молекула, переходящая из жидкости сквозь поверхностный слой в газ, совершает работу по преодолению сил межмолекулярного притяжения.
В газ переходят лишь те молекулы, энергия которых больше работы перехода. Поэтому средняя энергия оставшихся в жидкости молекул уменьшается, испаряющаяся жидкость охлаждается. Для поддержания интенсивности испарения постоянной к жидкости нужно подводить тепло. Одновременно с испарением происходит конденсация, то есть переход молекул из пара в жидкость. Если преобладает испарение, то количество жидкости уменьшается, а пара - увеличивается. Если преобладает конденсация, ситуация противоположная.
Между потоками молекул может быть и равновесие. Оно наступает при определенной для данной температуры плотности пара. Эту плотность называют равновесной, а пар насыщенным. Состояние равновесия является динамическим. Давление насыщенного пара называют часто упругостью насыщенного пара.
9. Теплота испарения – это энергия, необходимая для испарения жидкости без изменения температуры при внешнем давлении, равном давлению насыщенных паров при этой температуре. Различают ещё молярную и удельную теплоту испарения. Молярная Â=Qçn – это теплота, необходимая для испарения 1 моля жидкости. Единица измерения Â – Джçмоль. Удельная теплота испарения – это теплота r, необходимая для испарения 1 кг жидкости. Единица измерения r – Джçкг. Очевидно, r = Qçm=ÂçM, где М – молярная масса жидкости.
В таблице 26 приведены значения молярной Â и удельной r теплоты испарения некоторых веществ при температуре их кипения при нормальным давлении p =1,01×105 Па.
Таблица 26
| Вещество | Ткип, К | Â, 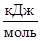
| 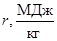
| Вещество | Ткип, К | Â, 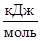
| 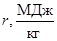
| |
| Азот | 77,4 | 5,58 | 0,199 | Кислород | 6,82 | 0,213 | ||
| Ацетон | 30,2 | 0,521 | Углекислота СО2 | 12,0 | 0,573 | |||
| Вода | 40,6 | 2,256 | Ртуть | 58,6 | 0,293 | |||
| Водород | 0,908 | 0,454 | Спирт этил. | 41,7 | 0,906 | |||
| Воздух | 81-78 | 5,71 | 0,197 | Эфир этил. | 26,3 | 0,355 |
Теплота испарения складывается из двух частей, Q = Qp + Qa. Член Qp есть работа, совершаемая паром по преодолению внешнего давления, Qp= p(V2– V1). (24.1)
Здесь V1 – объем жидкости, V2 – объем пара. Член Qa определяет работу выхода молекул через поверхностный слой.
Например, для 1 моля воды при 100°С Q = Qp + Qa = (3540 + 37060) Дж = 40600 Дж. Отношение QpçQa = 3540ç37060 » 0,1 (для воды). При испарении в вакууме Qp = 0.
10.  Зависимость теплоты испарения от температуры. С повышением температуры различие в энергиях молекул жидкости и пара уменьшается. Поэтому теплота испарения с ростом температуры уменьшается и в критической точке, где исчезает различие между жидким и газообразным состояниями, обращается в нуль. Теоретически не удается получить простую зависимость r(T). Однако она хорошо апроксимируется эмпирической формулой
Зависимость теплоты испарения от температуры. С повышением температуры различие в энергиях молекул жидкости и пара уменьшается. Поэтому теплота испарения с ростом температуры уменьшается и в критической точке, где исчезает различие между жидким и газообразным состояниями, обращается в нуль. Теоретически не удается получить простую зависимость r(T). Однако она хорошо апроксимируется эмпирической формулой 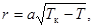 (24.2)
(24.2)
где Тк – критическая температура жидкости, а – коэффициент, свой у разных жидкостей.
На рис.100 сплошной линией показана опытная зависимость r(T) для воды. Штриховая линия вычислена по формуле (24.2). Коэффициент а определен при Т=373 К и составляет для воды а = 0,136 МДж| (кг×К1|2).
В пределах от 0 до 100°С формула (24.2) завышает значение r не более чем на 6%. При t > 100°С формула прогнозирует меньшее значение r. Относительная погрешность Dr/r растет по мере приближения к критической температуре, достигая – 11% к 250°С и – 17% к 300°С. Максимального значения - около 50% - относительная погрешность достигает в окрестности критической температуры. Это вполне приемлемое приближение позволяет использовать формулу (24.2) для теоретических оценок.
11. Зависимость давления насыщенных паров от температуры можно найти в явной форме из уравнения Клапейрона – Клаузиуса, если:
а. Пренебречь объемом жидкости по сравнению с объемом пара. Для 1 моля воды, например, V1 = 0,018 л, а V2(пар) = 22.4 л. Отношение V1(вода) ç V2(пар) = 0,018 ç 22,4 » 0,001. Это вполне приемлемое условие.
б. Допустить, что к пару применимо уравнение Клапейрона – Менделеева. При температурах меньших 100°С давление Н2О, вычисленное по формуле p = rRTçM, где r - реальная плотность пара, заметно отличается от реального давления лишь вблизи температуры кипения и приближается к +1,5% при 100°С. С дальнейшим ростом температуры погрешность меняет знак и достигает –3% при 200°С. Это также вполне приемлемая точность.
С учетом принятых условий запишем уравнение Клапейрона – Клаузиуса для жидкости и пара: 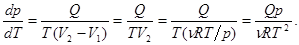 (24.3)
(24.3)
Для того, чтобы его проинтегрировать, надо знать зависимость теплоты испарения Q от температуры Т. Если воспользоваться эмпирической формулой (24.2), то после разделения переменных уравнение принимает вид: 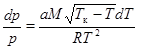 . (24.4)
. (24.4)
Если перейти к безразмерной переменной x = (Tк-TçTк, то Tк - T = Ткх, 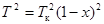 , dT = - Tк dx. Уравнение (24.4)принимает вид:
, dT = - Tк dx. Уравнение (24.4)принимает вид: 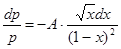 . (24.5)
. (24.5)
Здесь 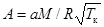 - безразмерный коэффициент. Интегрируем правую часть уравнения по частям. Обозначим
- безразмерный коэффициент. Интегрируем правую часть уравнения по частям. Обозначим 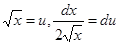 .
. 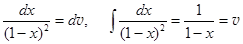 . (24.6)
. (24.6)
Отсюда, 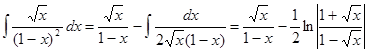 . (24.7)
. (24.7)
Жидкости существуют при температурах Т < Тк. Поэтому 0£ x < 1. Выражение под знаком логарифма всегда положительно, поэтому модульные скобки можно опустить. Зависимость давления насыщенных паров от температуры принимает вид:
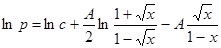 , или
, или 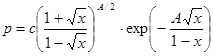 . (24.8)
. (24.8)
 Постоянную интегрирования с лучше определять в той области температур, в которой предполагается использование формулы для расчетов. Для воды, например, А =11,60. Если постоянную с вычислить при температуре 200°С, х0=(Тк- Т0) ç Тк=(647-473) ç 647 =0,269 и найденное из опыта при температуре Т0=473 К p0=15,55×105 Па, то с =7,42 МПа.
Постоянную интегрирования с лучше определять в той области температур, в которой предполагается использование формулы для расчетов. Для воды, например, А =11,60. Если постоянную с вычислить при температуре 200°С, х0=(Тк- Т0) ç Тк=(647-473) ç 647 =0,269 и найденное из опыта при температуре Т0=473 К p0=15,55×105 Па, то с =7,42 МПа.
Вычисленное при этом значении с давление насыщенных паров при 0°С больше действительного на 6%, а в критической точке меньше его в 3 раза.
На рис.101 сплошной линией показана зависимость давления насыщенных паров воды рнас от температуры, измеренная в опытах. В интервале температур от 0°С до 100°С давление паров растет от 611 Па до 101 кПа, то есть на три порядка. При критической температуре рнас=22 МПа.
Штриховой линией показана зависимость рнас(Т), вычисленная по формуле (24.8).
12. Водяной пар в атмосфере. Влажность. Наличие водяных паров в атмосфере имеет большое значение как для динамики атмосферных процессов, так и для живой природы.
Масса водяных паров в единице объема воздуха называется абсолютной влажностью и обозначается Е. Очевидно Е = r, где r - плотность водяных паров в воздухе.
Максимальная абсолютная влажность Еmах в обычных условиях соответствует плотности насыщенных паров rнас при данной температуре. Большую часть времени содержание паров в приземном слое умеренного пояса меньше Еmах. Отношение плотности паров в воздухе r к плотности насыщенных паров в воздухе при данной температуре называется относительной влажностью е, 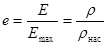 . (24.9)
. (24.9)
Относительную влажность е определяют также через отношение давлений е = рçрнас. Поскольку насыщенные пары при высоких температурах не очень хорошо подчиняются уравнению Клапейрона – Менделеева p = rRTçM, рост давления несколько отстает от роста плотности, то относительная влажность е, найденная через отношение давлений, на 1 - 2% больше влажности, вычисленной через отношение плотностей: 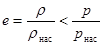 . (24.10)
. (24.10)
Если при некоторой температуре Т воздух далек от насыщения, относительная влажность меньше 100%, то при охлаждении воздуха относительная влажность е повышается и при некоторой температуре Трос может достигнуть 100%.
Рост величины е объясняется тем, что хотя числитель дроби e =rçrнас пока не меняется, знаменатель rнас с понижением температуры падает. Температура Трос, при которой знаменатель сравняется с числителем, rнас= r, называется точкой росы. При дальнейшем охлаждении воздуха, начиная с температуры Трос, часть паров конденсируется в виде капель росы. Абсолютная влажность Е = rнас уменьшается, а относительная остается постоянной и равной 100%.
Природное явление выпадения росы наблюдается в теплое время года при плюсовых температурах в ночное время, когда становится прохладно. Для выпадения росы нужно, чтобы относительная влажность е была достаточно высокой. В этом случае температура воздуха при ночном охлаждении может достигнуть точки росы.
13. Кипение – это процесс испарения при той температуре, при которой давление насыщенных паров оказывается равным внешнему давлению.
Когда рнас < pвнеш, испарение носит спокойный характер, переход молекул из жидкости в пар происходит только на свободной поверхности жидкости.
 Когда температура жидкости достигает того значения, при котором рнас = pвнеш, паровая фаза может возникать уже в любой точке объема жидкости в виде пузырьков. При достаточно интенсивном подведении к жидкости тепла испарение приобретает бурный характер, образование паровой фазы происходит во всем объеме жидкости. Можно сказать, что кипение – это объемное парообразование.
Когда температура жидкости достигает того значения, при котором рнас = pвнеш, паровая фаза может возникать уже в любой точке объема жидкости в виде пузырьков. При достаточно интенсивном подведении к жидкости тепла испарение приобретает бурный характер, образование паровой фазы происходит во всем объеме жидкости. Можно сказать, что кипение – это объемное парообразование.
С повышением давления температура кипения повышается. Это видно из рис.102, на котором показана зависимость давления насыщенных паров воды от температуры. В отличие от рис.101 давление р откладывалось на вертикальной оси в логарифмическом масштабе. Благодаря этому стали графически доступными участки с низкими температурами, а также изменилось направление кривизны кривой.
Чем больше внешнее давление, тем большего значения рнас нужно достичь, тем до более высокой температуры нужно нагреть жидкость. При атмосферном давлении, когда pнас=1,01×105 Па, tкип=100°С. Если давление поднять до трех атмосфер, tкип повышается до 136°С. При давлении 15 атмосфер вода закипает при температуре около 200°С. Если давление увеличить более 226 атмосфер, соответствующих давлению насыщенных паров при критической температуре tкрит=347°С, то процесс кипения происходить не будет, вода будет переходить в газообразное состояние по всему объему без образования границ раздела жидкой и паровой фаз.
Понижая внешнее давление, можно снижать температуру кипения. Так на вершине горы Джомолунгма, где давление атмосферы составляет 0,36×105 Па, вода закипает при температуре около 75°С.
Чтобы началось кипение, жидкость должна иметь центры парообразования. Ими обычно являются микроскопические пузырьки какого-либо газа. Если центров парообразования нет, жидкость может нагреваться до температуры выше точки кипения. Это метастабильное состояние перегретой жидкости.
Дата добавления: 2020-05-20; просмотров: 803;











