ПОНЯТИЕ О СКОРОСТИ И РАВНОВЕСИИ ХИМИЧЕСКИХ ПРОЦЕССОВ
Любой процесс химических превращений складывается из трех последовательных взаимосвязанных актов: подвода реагирующих компонентов в зону реакции, химической реакции и отвода полученных продуктов из зоны реакции.
Суммарная скорость такого процесса определяется скоростями перечисленных элементарных стадий, которые также протекают с различной скоростью. Общая скорость процесса в итоге определяется скоростью его наиболее медленной стадии. Поэтому на практике для ускорения любых производственных и технологических процессов в первую очередь интенсифицируют скорость наиболее медленной стадии.
Подвод реагентов в зону реакции и отвод продуктов из зоны реакции может совершаться физическим транспортированием вещества за счет беспорядочного движения самих молекул (молекулярной диффузии), естественного или принудительного переноса (конвекции) либо интенсивного перемешивания (турбулентной диффузии).
В многофазных системах твердые компоненты подводятся в реакционную зону растворением в жидкости, плавлением, испарением или возгонкой с конденсацией паров, а газообразные — растворением в жидкости либо улавливанием твердым поглотителем. При этом переход из одной фазы в другую по схеме
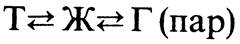
во многих случаях оказывается наиболее медленным и потому лимитирующим скорость технологического процесса.
Химические реакции составляют основу химико-технологических процессов и отличаются чрезвычайным разнообразием фазового достояния реагентов, условиями проведения и механизмом протекания. Обычно химическое превращение вещества может состоять из ряда последовательных или параллельных химических реакций, в результате которых образуются как основные и побочные продукты, имеющие народнохозяйственное значение, так и отходы производства. Побочные продукты и отходы могут получаться как в результате основных, так и побочных реакций вследствие неизбежного присутствия примесей в сырье.
При оценке скорости взаимодействия веществ учитываются не все реакции, а лишь те, которые имеют определяющее влияние на качество и количество получаемых основных продуктов.
Многие химические превращения протекают как в прямом, так и в обратном направлении, что усложняет оценку скорости процесса. По этому признаку различают обратимые и необратимые реакции. Необратимые реакции в отличие от обратимых протекают лишь в одном направлении.
Все обратимые реакции стремятся к равновесию, при котором скорости прямого и обратного процессов уравниваются. При достижении равновесия суммарная скорость процесса оказывается равной нулю, а соотношение между компонентами — неизменным. Лишь изменением внешних условий, например температуры, давления, концентрации компонентов, можно нарушить равновесие и направить протекание процесса в том или ином направлении до наступления нового равновесного состояния.
Качественное влияние условий процесса на равновесие химических реакций определяется принципом Ле-Шателье, согласно которому в системе, выведенной внешним воздействием из состояния равновесия, самопроизвольно происходят изменения, стремящиеся вернуть систему к равновесию.
Использование принципа Ле-Шателье позволяет качественно оценивать целесообразность применения того или иного внешнего воздействия для направленного смещения равновесия в сторону, обеспечивающую максимальный выход конечного продукта.
Так, например, если обратимая реакция типа
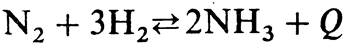
протекает с выделением теплоты, то в соответствии с принципом Ле-Шателье для сдвига равновесия вправо необходимо: понижать температуру (отводить теплоту), так как процесс экзотермический; повышать давление, так как гомогенный процесс в газовой фазе протекает с уменьшением объема (из 1 + 3 = 4 молекул азотоводородной смеси получается 2 молекулы аммиака); уменьшать концентрацию аммиака в системе (непрерывно отводить аммиак из зоны реакции); повышать концентрацию исходных веществ (азота и водорода), поскольку повышение концентрации одного из них увеличивает степень превращения другого.
Таким образом, для сдвига равновесия реакции вправо обычно в качестве практических приемов используют подвод или отвод теплоты, изменение давления, увеличение концентрации реагирующих компонентов, вывод конечных продуктов из зоны реакции. Эти и другие факторы значительно изменяют скорость химических превращений.
Скорость обратимых реакций зависит от степени приближения взаимодействующих систем к равновесному состоянию.
Количественно подвижное равновесие между исходными веществами и продуктами реакции для всех химических процессов определяется константой равновесия Кр , при которой скорости прямой и обратной реакции равны.
Обычно константы равновесия определяются опытным путем либо приводятся в специальных справочниках. Это позволяет по известному значению величины Кр рассчитывать состав продуктов реакции при условии равновесия, а также равновесную степень превращения при различных условиях процесса. Таким образом, зная константу равновесия, можно определить предельную полноту протекания процесса, достигаемую в условиях равновесия реакции.
Как известно, скорость химико-технологического процесса представляет собой результирующую скорость прямой, обратной и побочных реакций, а для гетерогенных процессов также скорость транспортирования (диффузии) исходных веществ в зону реакций и продуктов из зоны.
Результирующая скорость химико-технологического процесса определяется не только скоростью химической реакции, но и скоростью подвода и отвода веществ из реакционной зоны. При существующих методах физической транспортировки вещества скорость его подвода или отвода из зоны реакции определяется в конечном итоге скоростью диффузии компонентов.
Скорость диффузии зависит от свойства вещества, температуры, давления и скорости потока. Так, пособность молекул газа диффундировать в неподвижную жидкость в 104 — 105 раз меньше способности газа диффундировать в другой газ. Таким образом, молекулярная диффузия является весьма медленным процессом, особенно в неподвижных жидкостях. В движущихся или перемешиваемых жидкостях, газах, газожидкостных или других взаимодействующих потоках скорость диффузии прямо пропорциональна скорости движущегося потока. Поэтому турбулизация потоков является важнейшим приемом интенсификации процесса переноса компонентов из фазы в фазу через границу раздела в системах Г - Ж, Ж - Ж, Ж - Г, Г - Т.
Влияние остальных факторов (температуры и особенно давления) на скорость диффузии по сравнению со скоростью химической реакции проявляется в значительно меньшей степени.
Поскольку результирующая скорость химико-технологического процесса определяется скоростью его наиболее медленной стадии, то для интенсификации и ускорения процесса в целом необходимо знать, какой области процесса соответствует наиболее медленная стадия. По этому признаку в химико-технологическом процессе различают диффузионную, кинетическую и переходную области.
Так, если скорость химической реакции больше скорости диффузии, то скорость всего процесса будет определяться скоростью более медленной диффузии. В этом случае процесс протекает в диффузионной области и для ускорения его следует использовать факторы, интенсифицирующие диффузию.
Если скорость химической реакции значительно меньше, чем скорость диффузии, то скорость всего процесса определяется скоростью химической реакции. В этом случае процесс протекает в кинетической области и для его интенсификации следует принять меры для ускорения реакции.
Если же скорости диффузии и реакции соизмеримы, то процесс идет в переходной области и для его ускорения необходимо воздействовать и на диффузию, и на химическую реакцию.
Установление области, в которой протекает процесс, производится анализом экспериментальных данных по влиянию температуры и скорости потока на скорость превращения.
Если при низких температурах суммарная скорость реакции не зависит от скорости подачи реагентов, но значительно возрастает с увеличением температуры, то это значит, что при низких температурах процесс протекает в кинетической области. Если в некотором интервале температур суммарная скорость реакции заметно увеличивается с ростом температуры и на ее рост оказывает влияние повышение скорости подвода реагентов, то это значит, что при данных температурных условиях процесс протекает в переходной области. В случае, когда результирующая скорость химической реакции практически не зависит от температуры, но значительно возрастает с увеличением скорости подачи реагентов, процесс протекает в диффузионной области.
Дата добавления: 2016-06-22; просмотров: 3152;











