ХИМИЧЕСКИХ ПРОЦЕССОВ
Знание основных закономерностей химико-технологического процесса позволяет найти оптимальные условия его проведения и интенсификации, улучшить технико-экономические показатели. Одним из главных факторов, обеспечивающих нормальное функционирование процесса, является технологический режим производства, представляющий собой совокупность большого числа технологических параметров. Поэтому по общепринятой технологической классификации, основанной на параметрах производства, все химические процессы делятся на: высокотемпературные, низкотемпературные некаталитические, каталитические (проходящие под повышенным или пониженным давлением), электрохимические, биохимические, радиационно-химические, плазмохимические, фотохимические и некоторые другие. Здесь за основу классификации выбраны параметры, оказывающие решающее влияние на процесс.
Помимо указанных параметров для подобных процессов большое значение имеет их непрерывность, цикличность и энергоемкость, а для улучшения технико-экономических показателей процесса очень важным оказывается направление движения материальных и тепловых потоков, агрегатное состояние взаимодействующих веществ, тепловой эффект реакции.
По направлению движения тепловых и материальных потоков в аппаратах различают прямоточные, противоточные процессы и процессы с перекрестным и смешанным током.
В прямоточном процессе тепловые или материальные потоки движутся параллельно друг другу в одном и том же направлении. При наличии разделяющей стенки такой вариант процесса используется для теплообмена, в результате которого более горячий поток охлаждается и отдает теплоту более холодному потоку. Последний при этом нагревается.
При отсутствии разделяющей перегородки прямоток может использоваться как для теплообмена (например, сушка материалов горячими газами), так и для смешения газов, паров и жидкостей (например, разбавление серной кислоты водой, смешение аммиака или паров метилового спирта с воздухом перед их окислением на катализаторе). В отдельных случаях смешение и теплообмен происходят одновременно.
В противоточных процессах тепловые или материальные потоки движутся в противоположных направлениях. Теплообмен через стенку при противотоке протекает более интенсивно, чем при прямотоке. При прочих равных условиях осуществление такого процесса требует меньшей поверхности теплопередачи, что способствует уменьшению габаритов теплообменников, снижению их материалоемкости.
Противоточное движение потоков без разделяющей их стенки широко используется в технологии для интенсификации таких типовых процессов, как улавливание и очистка газов жидкими и твердыми поглотителями, разделение жидких многокомпонентных смесей ректификацией и экстракцией, очистка и избирательное разделение многокомпонентных и жидких смесей твердыми поглотителями.
Обычно перечисленные процессы совмещаются с процессами теплообмена и проводятся в одном и том же аппарате. Это снижает себестоимость продукции за счет использования более компактного и интенсивно работающего оборудования, способствует сокращению производственных площадей.
В процессах с перекрестным током тепловые и материальные потоки движутся перпендикулярно друг другу.
При смешанном токе один из потоков движется в одном направлении, а другой — как прямотоком, так и противотоком.
Перекрестный и смешанный токи широко используются для интенсификации тепловых процессов, связанных с нагреванием, охлаждением, выпариванием веществ и конденсацией паров.
По агрегатному состоянию все системы взаимодействующих веществ и соответствующие им технологические процессы делятся на гомогенные и гетерогенные. Система — это любая группа веществ, находящихся во взаимодействии, а фаза — совокупность однородных частей системы, одинаковых по составу, химическим и физическим свойствам и отграниченных от других Частей поверхностью раздела.
Гомогенными системами называются такие системы, в которых все реагирующие вещества находятся только в какой-либо одной фазе: газовой — Г, жидкой — Ж или твердой — Т. В отличие от гомогенных в гетерогенных системах вещества находятся в разных агрегатных состояниях. Например, одно — в газообразном, второе — в жидком, третье — в твердом состоянии. На практике гетерогенные системы отличаются большим разнообразием количества фаз и числа сочетаний между ними.
Различают двухфазные гетерогенные системы типа Г — Ж, Г — Т, Т — Т, Ж — Т и несмешивающиеся Ж1 — Ж2 (например, «вода — масло»), а также многофазные системы. Примером многофазных систем могут быть Г-Ж-Т, Ж-Т1-Т2, Г-Ж-Т1-Т2 и др.
В гомогенных системах взаимодействие веществ и реакции между ними происходят обычно быстрее, чем в гетерогенных, из-за отсутствия границы раздела фаз. Наличие границы раздела резко замедляет скорость перехода компонентов из одной фазы в другую. Например, в процессах растворения и равномерного распределения легирующих добавок в расплавленном металле, поглощения газов твердыми или жидкими поглотителями скорость процесса при обычных условиях может снижаться до скорости молекулярной диффузии. Это значит, что скорость такого процесса лимитируется скоростью его наиболее медленной, диффузионной стадии.
Поскольку гетерогенные процессы протекают медленнее гомогенных и отличаются более сложным механизмом управления, одним из методов интенсификации промышленного производства является рациональное сведение гетерогенных процессов к гомогенным. Для этого твердые реагирующие вещества по возможности переводят в жидкое состояние плавлением или растворением, парообразные вещества конденсируют, газообразные сжижают или растворяют в жидкостях. Такая замена гетерогенных систем на гомогенные позволяет в ряде случаев интенсифицировать производственный процесс, упростить аппаратурное оформление его отдельных технологических стадий, снизить трудовые затраты, уменьшить себестоимость продукции, рациональнее использовать тепловой эффект процесса.
По тепловому эффекту химические процессы подразделяются на экзотермические и эндотермические.
Экзотермическими процессами называются процессы, при которых теплота выделяется, а эндотермическими — процессы, при которых теплота поглощается.
Числовое значение величин теплового эффекта определяется строением вещества и особенностями его переработки. Обычно тепловой эффект проявляется при сгорании вещества, образовании нового химического соединения, либо изменении агрегатного состояния вещества при его растворении, плавлении, испарении или конденсации.
Примером экзотермических процессов может быть конденсация водяного пара, растворение многих ангидридов кислот в воде, сжигание простейших веществ (серы, фосфора) для получения их оксидов и т. п. Примером эндотермических процессов является получение водяного пара нагреванием воды, выплавка чугуна из руд, выделение фосфора из апатитов возгонкой, синтез водорода при крекинге углеводородов и т. д.
Отличительной особенностью эндотермических процессов является высокий расход топлива и электроэнергии для подвода теплоты в зону обработки, в то время Как экзотермические процессы характеризуются значительным расходом охлаждающего теплоносителя (воды, поруха и др.) для отвода теплоты.
В промышленности большая экономия топлива, охлаждающих теплоносителей и электроэнергии достигается совмещением экзотермических и эндотермических эффектов в одном технологическом процессе. Часто удается так отрегулировать температурный режим и скорость движения обменивающихся теплотой потоков, что количество выделяемой теплоты полностью компенсируется количеством отводимой теплоты. И режим процесса становится автотермичным. Примером автотермичного режима может служить окисление на катализаторе диоксида серы SO2 до триоксида SO3 в производстве серной кислоты
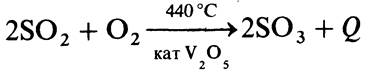
Здесь теплота реакции Q, уносимая с горячим газом SO3, передается через стенку встречному потоку холодного газа SO2, поступающему на окисление. В результате теплообмена между SO2 и SO3 газ сам себя нагревает, охлаждает и непрерывно поддерживает в зоне окисления оптимальную температуру процесса ~440°С.
В отдельных случаях для утилизации теплоты используется попеременное чередование экзо- и эндотермических эффектов в одном аппарате.
Например, при получении генераторных газов попеременным чередованием воздушного (теплота выделяется) и водяного дутья (теплота поглощается) удается вести процесс с наименьшим расходом топлива за счет периодически используемой теплоты экзотермической реакции. При этом наряду с экономией топлива предотвращается перегрев аппарата, прогорание его стенок и обеспечивается необходимая скорость процесса.
Дата добавления: 2016-06-22; просмотров: 3022;











