Изменение энтропии как критерий обратимости и необратимости процессов
На основе второго начала термодинамики можно выяснить возможность протекания процесса в данном направлении в различных условиях.
Из выражения второго начала термодинамики в интегральном виде
DS 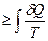
следует, что изменение энтропии может служить критерием направления процесса:
если DS> 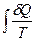 , то процесс является необратимым, т.е. может протекать самопроизвольно.
, то процесс является необратимым, т.е. может протекать самопроизвольно.
Если же DS< 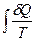 , то процесс в данном направлении невозможен; если DS=
, то процесс в данном направлении невозможен; если DS= 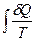 , то система находится в состоянии равновесия.
, то система находится в состоянии равновесия.
Из-за сложности расчета 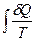 удобнее использовать энтропию, как критерий направления процесса, в изолированной системе. В изолированной системе нет обмена энергией, т.е. δQ = 0, тогда
удобнее использовать энтропию, как критерий направления процесса, в изолированной системе. В изолированной системе нет обмена энергией, т.е. δQ = 0, тогда
(DS)v,u >0
DS > 0 - процесс идет в прямом направлении;
DS < 0 - процесс невозможен в прямом направлении;
DS = 0 - состояние равновесия.
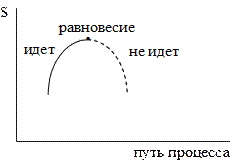
Рисунок 1.5 – Зависимость энтропии и в изолированной системе от пути перехода
Таким образом, в изолированных системах возможны те процессы, которые идут с ростом энтропии, а равновесие наступает при достижении максимального значения энтропии, 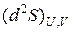 < 0 (условие максимума).
< 0 (условие максимума).
Дата добавления: 2016-06-22; просмотров: 1873;











