Характеристика энтропии
1.Энтропия – это экстенсивное свойство системы. S, 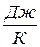 . Она может быть удельной S,
. Она может быть удельной S, 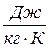 и молярной S,
и молярной S, 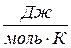 (интенсивное свойство).
(интенсивное свойство).
Изменение энтропии не зависит от способа проведения процесса (обратимого или необратимого). Однако для обратимого процесса 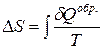 , а для необратимого
, а для необратимого 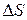 >
> 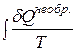 . Это объясняется не увеличением ΔS, а тем, что
. Это объясняется не увеличением ΔS, а тем, что 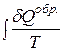 >
> 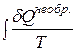 , поскольку теплота является функцией процесса.
, поскольку теплота является функцией процесса.
2.Изменение энтропии характеризует направление процесса (описано выше).
3.Энтропия – мера неупорядоченности системы.
Степень беспорядоченности можно характеризовать затруднительностью возвращения системы в более упорядоченное состояние: два газа легко смешиваются, но разделение их сложно. После перемешивания энтропия системы возросла, поэтому энтропия является мерой неупорядоченности системы.
4Энтропия и термодинамическая вероятность.
Состояние газа, определяемое значениями параметров P, V, T, называют макросостоянием. Однако частицы газа находятся в тепловом движении, из-за этого их положения в объеме непрерывно меняются и в каждом положении энергия частицы так же меняется. Совокупность значений координат и импульсов всех частиц называется микросостоянием системы. Одному макросостоянию отвечает множество микросостояний.
Число микросостояний при одном макросостоянии называется термодинамической вероятностью этого макросостояния, W.
W может иметь целочисленные значения от единицы до весьма большого числа.
Согласно формуле Больцмана
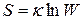
В состоянии равновесия энтропия достигает своего максимального значения, поскольку равновесие есть наиболее вероятное состояние и, следовательно, является макросостоянием, осуществляемым посредством максимального числа микросостояний, т.е. W = max.
В случае идеального кристалла при Т = 0 макросостояние осуществляется только одним микросостоянием, W = 1, S = 0. (S = 0 термодинамически следует из теплового закона Нернста и постулата Планка).
Дата добавления: 2016-06-22; просмотров: 2455;











