Определение общего азота по Кьельдалю
Реактивы. 1. Концентрированная серная кислота. 2. Металлический селен в порошке. 3. Кристаллогидрат CuSO4 • 5Н20. 4. 0,1 и. раствор H2SO4 (титрованный). 5. 40-процентный раствор щелочи. 6. 0,1 и. титрованный раствор щелочи 7. Реактив Несслера K2(HgI4).
Метод основан на каталитическом озолении органического вещества. Окислителем в этом случае служит серная кислота, которая восстанавливается до оксида серы (IV), а образующийся аммиак связывается в сульфат аммония, который разрушается щелочью, при этом выделяется аммиак. На аппарате Кьельдаля аммиак отгоняют в титрованный раствор серной кислоты, где он снова связывается в сульфат аммония. Остаток серной кислоты оттитровывают щелочью.
По разности между количеством серной кислоты в приемнике до отгона аммиака и остатком ее по окончании отгона находят количество аммиака, связанного серной кислотой (в мг-экв), а затем путем пересчета определяют содержание азота в анализируемом веществе в процентах.
Ход анализа. 1. Возьмите 0,5 г воздушносухого или 2 г свежего исследуемого растительного вещества и поместите его в колбу Кьельдаля емкостью 500 мл (рис. 17).
Рис. 17. Перенесение навески в колбу Кьельдаля
2. Залейте навеску в колбе 10 мл концентрированной серной кислоты и оставьте на 12—24 ч.
3. После этого в колбу добавьте 0,1 г селена или 0,5 г сульфата меди, поставьте колбу в наклонном положении на электрический колбонагреватель или штатив с газовой горелкой (рис. 18).
Рис. 18. Установка для сжигания органического вещества в колбе Кьельдая
4. В колбу поместите маленькую воронку и постепенно нагревайте содержимое колбы. Вспенивания при этом не должно быть.
5. Когда появятся белые пары, нагревание усильте и кипятите до полного обесцвечивания жидкости. Это указывает на окончание окисления вещества.
6. Закончив окисление вещества и охладив колбу Кьельдаля, в нее осторожно добавьте 150—200 мл дистиллированной воды и 1-2 капли фенолфталеина.
7. Одновременно с этим приготовьте приемник: в химический стакан емкостью 300—500 мл налейте 30 мл 0,1 и. раствора серной кислоты и прибавьте 3—4 капли индикатора — конго красного или метилового красного.
8. Колбу с титрованной серной кислотой установите под холодильник аппарата Кьельдаля (рис. 19) так, чтобы кончик трубки холодильника был погружен в кислоту.

Рис. 19. Аппарат Кьельдаля для отгона аммиака
9. После этого, держа отгонную колбу в наклонном положении, осторожно по внутренней стенке колбы прилейте из цилиндра 60 мл 40-процентного раствора щелочи, чтобы она вся опустилась на дно колбы.
10. Колбу немедленно закройте пробкой и содержимое ее осторожно взболтайте. Появление темно-малинового окрашивания раствора укажет на то, что щелочи влито достаточное количество (при отсутствии окрашивания необходимо добавить щелочи).
11. Проведите отгонку аммиака, контролируя окончание процесса реактивом Несслера. В пробирку с реактивом Несслера добавьте несколько капель дистиллята. Если раствор не пожелтеет, то нужно прекратить отгон аммиака.
12. Конец трубки холодильника сполосните дистиллированной водой, сливая ее в приемник, содержимое его оттитруйте 0,1 н. раствором щелочи до изменения окраски-жидкости в стакане из синей (в кислой среде) в красную (если индикатор конго красный) или из красной в золотистую (если индикатор метиловый красный).
13. Если окраска жидкости в приемнике изменилась еще в процессе отгона, немедленно прилейте в приемник дополнительно 20 мл 0,1 н. раствора серной кислоты.
Вычислите результаты анализа по формуле:
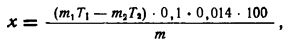
где х — содержание азота в процентах на абсолютно сухое вещество; m — навеска исследуемого вещества (в г); m1 — количество миллилитров 0,1 н. раствора серной кислоты, взятой в приемник; Т1 — поправка к титру этой кислоты; m2— количество миллилитров 0,1 н. раствора щелочи, израсходованной на титрование остатка серной кислоты в приемнике; Т2— поправка к титру этой щелочи; 0,1 — нормальность титрованного раствора серной кислоты; 0,014— 1 мг-экв азота.
Дата добавления: 2024-11-30; просмотров: 363;











