Побочные подгруппы VI,VII группы: общая характеристика элементов подгруппы, свойства хрома, марганца и их соединений. Медико- биологическое значение.
Свойства элементов подгруппы хрома
| Атомный номер | Название | Электронная конфигурация | ρ г/см3 | t0пл. 0C | t0кип. 0C | ЭО | Атомный радиус, нм | Степень окисления |
| Хром Cr | [Ar] 3d54s1 | 7,2 | 1,56 | 0,125 | +1,+2,+3, +4,+5,+6 | |||
| Молибден Mo | [Kr] 4d55s1 | 10,2 | 1,3 | 0,135 | +1,+2,+3, +4,+5,+6 | |||
| Вольфрам W | [Xe] 4f145d46s2 | 19,3 | 1,4 | 0,141 | +1,+2,+3, +4,+5,+6 |
Физические свойства
Блестящие, сероватого цвета металлы. С увеличением атомного номера растут температуры плавления и кипения.
Вольфрам - самый тугоплавкий из известных металлов.
Химические свойства
В ряду Cr – Mo – W химическая активность падает.
С увеличением степени окисления элементов у их оксидов и гидроксидов законо-мерно происходит ослабление основных свойств и усиление кислотных. Высшим оксидам RO3 соответствуют кислоты H2RO4.
В том же направлении происходит усиление окислительных свойств соединений.
Хром и его соединения
Получение
Алюминотермия: Cr2O3 + 2Al  Al2O3 + 2Cr
Al2O3 + 2Cr
Восстановлением оксидов оксидом углерода (II).
Электролизом водных растворов соединений хрома.
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 6000C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2  2Cr2O3
2Cr2O3
2Cr + 3Cl2  2CrCl3
2CrCl3
2Cr + N2  2CrN
2CrN
2Cr + 3S  Cr2S3
Cr2S3
В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O  Cr2O3 + 3H2
Cr2O3 + 3H2
Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4)
В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl  CrCl2 + H2
CrCl2 + H2 
2Cr + 6HCl + O2  2CrCl3 + 2H2O + H2
2CrCl3 + 2H2O + H2 
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Соединения двухвалентного хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl  CrCl2 + 2H2O
CrCl2 + 2H2O
Соединения хрома (II) - сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl  2CrCl3 + H2
2CrCl3 + H2 
4Cr(OH)2 + O2 + 2H2O  4Cr(OH)3
4Cr(OH)3
Соединения трёхвалентного хрома
Оксид хрома (III)Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3  Cr2O3 + 3H2O
Cr2O3 + 3H2O
4K2Cr2O7  2Cr2O3 + 4K2CrO4 + 3O2
2Cr2O3 + 4K2CrO4 + 3O2 
(NH4)2Cr2O7  Cr2O3 + N2
Cr2O3 + N2  + 4H2O
+ 4H2O
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + 2NaOH  2NaCrO2 + H2O
2NaCrO2 + H2O
Cr2O3 + Na2CO3  2NaCrO2 + CO2
2NaCrO2 + CO2 
Cr2O3 + 6KHSO4  Cr2(SO4)3 + 3K2SO4 + 3H2O
Cr2(SO4)3 + 3K2SO4 + 3H2O
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
2Cr2O3 + 4KOH + KClO3  2K2Cr2O7(дихромат калия) + KCl + 2H2O
2K2Cr2O7(дихромат калия) + KCl + 2H2O
Гидроксид хрома (III) Cr(OH)3 - нерастворимое в воде вещество зелёного цвета.
Cr2(SO4)3 + 6NaOH  2Cr(OH)3
2Cr(OH)3  + 3Na2SO4
+ 3Na2SO4
Обладает амфотерными свойствами - растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3H2SO4  Cr2(SO4)3 + 6H2O
Cr2(SO4)3 + 6H2O
Cr(OH)3 + KOH  K[Cr(OH)4]
K[Cr(OH)4]
(или, упрощая, Cr(OH)3 + KOH  KCrO2(хромат калия) + 2H2O)
KCrO2(хромат калия) + 2H2O)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3  2Cr+2Cl2 + ZnCl2
2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2  6NaBr + 6NaCl + 8H2O + 2Na2Cr+6O4
6NaBr + 6NaCl + 8H2O + 2Na2Cr+6O4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3 - ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и H2SO4(конц.).
K2CrO4 + H2SO4  CrO3 + K2SO4 + H2O
CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4  2CrO3 + K2SO4 + H2O
2CrO3 + K2SO4 + H2O
CrO3 - кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH  K2CrO4 + H2O
K2CrO4 + H2O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + H2SO4  K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + K2SO4 + H2O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH  2K2CrO4 + H2O
2K2CrO4 + H2O
| кислая среда | ||
| 2CrO42- + 2H+ | 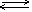
| Cr2O72- + H2O |
| щелочная среда |
Все соединения хрома (VI) - сильные окислители.
Свойства элементов подгруппы марганца
| Атомный номер | Название | Электронная конфигурация | ρ г/см3 | t0пл. 0C | t0кип. 0C | ЭО | Атомный радиус, нм | Степень окисления |
| Марганец Mn | [Ar] 3d54s2 | 7,45 | 1,6 | 0,131 | +2,+3,+4, +5,+6,+7 | |||
| Технеций Tc | [Kr] 4d55s2 | 11,5 | 1,36 | 0,136 | +2,+3,+4, +5,+6,+7 | |||
| Рений Re | [Xe] 4f145d56s2 | 20,53 | 1,46 | 0,137 | +3,+4,+5, +6,+7 |
Физические свойства: Серебристо-белые, тугоплавкие металлы.
Химические свойства
В ряду Mn – Tc – Re химическая активность понижается. Mn – металл средней активности, в ряду напряжений стоит до водорода и растворяется в соляной и серной кислотах:
Mn + 2H+  Mn2+ + H2
Mn2+ + H2 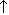
Re и Tc стоят в ряду напряжений после водорода. Они реагируют только с азотной кислотой:
3Tc + 7HNO3  3HTcO4 + 7NO
3HTcO4 + 7NO 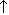 + 2H2O
+ 2H2O
С увеличением степени окисления усиливается кислотный характер оксидов и гидроксидов. (RO – основные; R2O7 – кислотные, им соответствуют кислоты HRO4).
Дата добавления: 2016-06-22; просмотров: 2193;











