Химические свойства
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется:
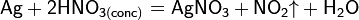
Растворяется оно и в хлорном железе, что применяется для травления:
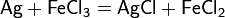
Серебро также легко растворяется в ртути, образуя амальгаму (жидкий сплав ртути и серебра).
Серебро не окисляется кислородом даже при высоких температурах, однако в виде тонких плёнок может быть окислено кислородной плазмой или озоном при облучении ультрафиолетом. Во влажном воздухе в присутствии даже малейших следов двухвалентной серы (сероводород, тиосульфаты, резина) образуется налёт малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий:
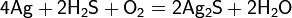
В отсутствии кислорода:
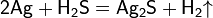
Свободные галогены легко окисляют серебро до галогенидов:
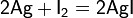
Однако на свету эта реакция обращается, и галогениды серебра (кроме фторида) постепенно разлагаются.
При нагревании с серой серебро даёт сульфид.
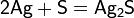 .
.
Серебро, в отличие от золота, не растворяется в "царской водке" из-за образования пленки хлорида на его поверхности.
Наиболее устойчивой степенью окисления серебра в соединениях является +1. В присутствии аммиака соединения серебра (I) дают легко растворимый в воде комплекс [Ag(NH3)2]+. Серебро образует комплексы так же с цианидами, тиосульфатами. Комплексообразование используют для растворения малорастворимых соединений серебра, для извлечения серебра из руд. Более высокие степени окисления (+2, +3) серебро проявляет только в соединении с кислородом (AgO, Ag2O3) и фтором (AgF2, AgF3), такие соединения гораздо менее устойчивы, чем соединения серебра (I).
Соли серебра (I), за редким исключением (нитрат, перхлорат, фторид), нерастворимы в воде, что часто используется для определения ионов галогенов (хлора, брома, йода) в водном растворе.
d- элементы. Медь. В организме взрослого человека содержится около 100 мг меди. Главная функция меди у высших организмов – каталитическая. В настоящее время известен целый ряд медьсодержащих ферментов (церулоплазмин, тирозиназа, цитохромоксидаза, супероксиддисмутаза).
Из соединений меди в медицине находит применение сульфат меди CuSO4*5H2O как антисептическое и вяжущее средство для наружного применения (раствор для смазывания ожоговой поверхности кожи, глазные капли и т.д.)
Цинк. Физиологическая роль цинка осуществляется благодаря связи его с ферментами. Цинк входит в состав эритроцитов, участвуя в газообмене и тканевом дыхании (ионы цинка входят в состав ферментов карбоангидразы).
Многие соединения цинка используются как вяжущие, антисептические средства для наружного применения.
ZnSO4*7H2O – глазные капли.
ZnO – присыпка, мази, пасты для кожных заболеваний.
Хром. Хром – постоянная составная часть растительных и животных организмов. Биологическая активность хрома объясняется способностью Cr+3 образовывать комплексные соединения. Например, ионы Cr+3 участвуют в стабилизации структуры нуклеиновых кислот.
Марганец. Это микроэлемент. Функция ионов Mn+2 состоит в регуляции активности ферментов. Ионы Mn+2 оказывают влияние на кроветворение, минеральный обмен, рост, размножение и т.д. Кроме того, ионы Mn+2 стабилизируют структуру нуклеиновых кислот.
В медицине используется перманганат калия KMnO4 .Этот антисептик применяется в водных растворах для промывания ран, полоскания горла и т.д.
Железо. Среди биоэлементов, важных для жизнедеятельности всех живых существ, железа играет главную роль, так как оно является активатором многих каталитических процессов в организме и участвует в транспортировке газов кровью.
В организме взрослого человека содержится около 3,5 г железа. Основная его масса сконцентрирована в гемоглобине эритроцитов. И хотя на долю атомов железа в гемоглобине приходится всего 0,35% массы, именно железо придаёт ей уникальное свойство – способность захватывать молекулярный кислород и отдавать его там, где он нужен.
Значительная часть железа содержится в мышечном белке – миоглобине, структурном родственнике гемоглобина, который так же способен обратимо связывать молекулярный кислород. При недостатке железа в организме человека развивается железодефицитная анемия.
Для лечения железодефицитных анемий, а также при слабости и истощении организма, применяются следующие препараты железа:
1. аскорбинат железа (II)
2. драже «Фероплекс» (сульфат железа (II) с аскорбиновой кислотой)
3. «Гематоген»
4. сироп алоэ с железом.
Дата добавления: 2016-06-22; просмотров: 2061;











