Марганец и его соединения. Марганец
Электронная конфигурация валентного слоя
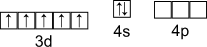
Получение
Алюмотермия: 3MnO2 + 4Al  2Al2O3 + 3Mn
2Al2O3 + 3Mn
Химические свойства
Металл средней активности. На воздухе покрывается тонкой плёнкой оксидов. Реагирует с неметаллами, например, с серой:
Mn + S  MnS
MnS
Растворяется в кислотах:
Mn + 2HCl  MnCl2 + H2
MnCl2 + H2 
(При этом образуются соединения двухвалентного марганца).
Соединения Mn(II)
Оксид марганца (II) MnO получается восстановлением природного пиролюзита MnO2 водородом:
MnO2 + H2  MnO + H2O
MnO + H2O
Гидроксид марганца (II) Mn(OH)2 - светло-розовое нерастворимое в воде основание:
MnSO4 + 2NaOH  Mn(OH)2
Mn(OH)2  + Na2SO4
+ Na2SO4
Mn2+ + 2OH-  Mn(OH)2
Mn(OH)2
Легко растворимо в кислотах:
Mn(OH)2 + 2HCl  MnCl2 + 2H2O
MnCl2 + 2H2O
Mn(OH)2 + 2H+  Mn2+ + 2H2O
Mn2+ + 2H2O
На воздухе Mn(OH)2 быстро темнеет в результате окисления:
2Mn(OH)2 + O2 + 2H2O  2[MnO2· 2H2O]
2[MnO2· 2H2O]
При действии сильных окислителей наблюдается переход Mn2+ в MnO2-:
2Mn(OH)2 + 5Br2 + 12NaOH  2NaMnO4 + 10NaBr + 8H2O (кат.CuSO4)
2NaMnO4 + 10NaBr + 8H2O (кат.CuSO4)
2Mn(NO3)2 + 5PbO2 + 6HNO3  2HMnO4 + 5Pb(NO3)2 + 2H2O
2HMnO4 + 5Pb(NO3)2 + 2H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO  2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7H2O
2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7H2O
Оксид марганца (IV) MnO2 - тёмно-коричневый порошок, нерастворимый в воде. Образуется при термическом разложении нитрата марганца (II):
Mn(NO3)2  MnO2 + 2NO2
MnO2 + 2NO2 
При сильном нагревании теряет кислород, превращаясь в Mn2O3 (при 6000C) или Mn3O4 (при 10000C).
Сильный окислитель:
MnO2 + 4HCl  MnCl2 + Cl2
MnCl2 + Cl2  + 2H2O
+ 2H2O
При сплавлении с содой и селитрой образует манганат натрия тёмно - зелёного цвета:
MnO2 + Na2CO3 + NaNO3  Na2MnO4 + NaNO2 + CO2
Na2MnO4 + NaNO2 + CO2 
Манганаты также могут быть получены при восстановлении перманганатов в щелочной среде:
Na2SO3 + 2KMnO4 + 2KOH  Na2SO4 + 2K2Mn+6O4 + H2O
Na2SO4 + 2K2Mn+6O4 + H2O
Гидролиз манганатов протекает по схеме:
3K2MnO4 + 2H2O  2KMnO4 + MnO2 + 4KOH
2KMnO4 + MnO2 + 4KOH
3MnO42- + 2H2O  2MnO4- + MnO2 + 4OH-
2MnO4- + MnO2 + 4OH-
За способность обратимо менять окраску манганат калия называют "минеральным хамелеоном".
Оксид марганца (VII) Mn2O7 - тёмно-зелёная жидкость, кислотный оксид. Получают действием концентрированной серной кислоты на кристаллический KMnO4 (марганцевая кислота HMnO4 нестабильна):
2KMnO4 + H2SO4  Mn2O7
Mn2O7 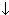 + K2SO4 + H2O
+ K2SO4 + H2O
При растворении в щелочах образует перманганаты:
Mn2O7 + 2KOH  2KMnO4 + H2O
2KMnO4 + H2O
Перманганат калия KMn+7O4 -тёмно-фиолетовое кристаллическое вещество, растворимое в воде. При нагревании разлагается с выделением кислорода:
2KMnO4  K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2 
Сильный окислитель, причём восстанавливается в кислой среде до Mn2+, в нейтральной – до Mn+4O2, а в щелочной – до Mn+6O42-.
Хром. Хром – постоянная составная часть растительных и животных организмов. Биологическая активность хрома объясняется способностью Cr+3 образовывать комплексные соединения. Например, ионы Cr+3 участвуют в стабилизации структуры нуклеиновых кислот.
Марганец. Это микроэлемент. Функция ионов Mn+2 состоит в регуляции активности ферментов. Ионы Mn+2 оказывают влияние на кроветворение, минеральный обмен, рост, размножение и т.д. Кроме того, ионы Mn+2 стабилизируют структуру нуклеиновых кислот.
В медицине используется перманганат калия KMnO4 .Этот антисептик применяется в водных растворах для промывания ран, полоскания горла и т.д.
Дата добавления: 2016-06-22; просмотров: 3157;











