Ртуть и ее соединения
Ртуть - серебристо-белый, блестящий, единственный жидкий при комнатной температуре металл; обладает низкой электропроводностью (она составляет 1,7% от электропроводности серебра) и большим коэффициентом термического расширения. На воздухе проявляет устойчивость. Реагирует с серой и галогенами:
Hg + S  HgS
HgS
Hg + Br2  HgBr2
HgBr2
Со многими металлами дает сплавы (амальгамы) (экзотермическое образование). Пары и соединения чрезвычайно ядовиты (накапливаются в организме).
Ртуть не растворяется в соляной и разбавленной серной кислотах (в ряду напряжений металлов ртуть находится после водорода; нормальный потенциал Hg / Hg 2+ = +0,85 в). Ртуть легко растворяется в концентрированной азотной кислоте – образуется нитрат ртути (II):
Hg + 4HNO3  Hg(NO3)2 + 2NO2
Hg(NO3)2 + 2NO2 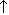 + 2H2O
+ 2H2O
При растворении ртути в разбавленной азотной кислоте образуется нитрат ртути (I),
6Hg + 8HNO3  3Hg2(NO3)2 + 2NO
3Hg2(NO3)2 + 2NO 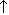 + 4H2O
+ 4H2O
При растворении ртути в горячей концентрированной серной кислоте в зависимости от избытка ртути или кислоты образуются соли одновалентной или двухвалентной ртути:
Hg + 2H2SO4  HgSO4 + SO2
HgSO4 + SO2 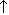 + 2H2O
+ 2H2O
2Hg + 2H2SO4  Hg2SO4 + SO2
Hg2SO4 + SO2 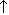 + 2H2O
+ 2H2O
Ртуть растворяется в царской водке:
3Hg + 2HNO3 + 6HCl  3HgCl2 + 2NO
3HgCl2 + 2NO 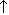 + 4H2O
+ 4H2O
Оксид ртути (II) HgO; красный кристаллический или желтый аморфный порошок; плохо растворим в воде; раствор имеет слабо щелочную реакцию.<
Получение
Hg2(NO3)2  2HgO + 2NO2
2HgO + 2NO2 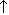
2Hg(NO3)2  2HgO + 4NO2
2HgO + 4NO2 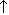 + O2
+ O2 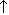
Дата добавления: 2016-06-22; просмотров: 2059;











