Общая характеристика элементов главной подгруппы V группы

Подгруппу азота составляют пять элементов: азот, фосфор, мышьяк, сурьма и висмут. Это р-элементы V группы периодической системы Д. И. Менделеева.
На наружном энергетическом уровне атомы этих элементов содержат пять электронов, которые имеют конфигурацию ns2np3 и распределены следующим образом:
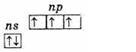
Поэтому высшая степень окисления этих элементов +5, низшая -3, характерна и +3.
Наличие трех неспаренных электронов на наружном уровне говорит о том, что в невозбужденном состоянии атомы элементов имеют валентность 3. Наружный уровень атома азота состоит только из двух подуровней — 2s и 2р. У атомов же остальных элементов этой подгруппы на наружных энергетических уровнях имеются вакантные ячейки d-подуровня. Следовательно, один из s-электронов наружного уровня может при возбуждении перейти на d-подуровень того же уровня, что приводит к образованию 5 неспаренных электронов.
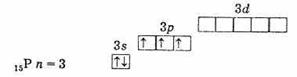
внешняя электронная оболочка фосфора (невозбужденный атом)
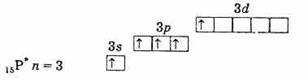
внешняя электронная оболочка возбужденного атома фосфора.
Таким образом, фосфор, мышьяк, сурьма и висмут в возбужденном состоянии имеют 5 неспаренных электронов, и валентность их в этом состоянии равна 5.
В атоме азота возбудить электрон подобным образом нельзя вследствие отсутствия d-подуровня на втором уровне. Следовательно, пятивалентным азот быть не может, однако он может образовать четвертую ковалентную связь по донорно-акцепторному механизму за счет неподеленной электронной пары 2s2. Для атома азота возможен и другой процесс. При отрыве одного из двух 2s-электронов азот переходит в однозарядный четырехвалентный ион N+.

От азота к висмуту радиусы атомов увеличиваются, а ионизационные потенциалы уменьшаются. Восстановительные свойства нейтральных атомов усиливаются от N к Bi, а окислительные ослабевают (см. табл. 21).
С водородом азот, фосфор и мышьяк образуют полярные соединения RH3, проявляя отрицательную степень окисления -3. Молекулы RH3 имеют пирамидальную форму. В этих соединениях связи элементов с водородом более прочные, чем в соответствующих соединениях элементов подгруппы кислорода и особенно подгруппы галогенов. Поэтому водородные соединения элементов подгруппы азота в водных растворах не образуют ионов водорода.
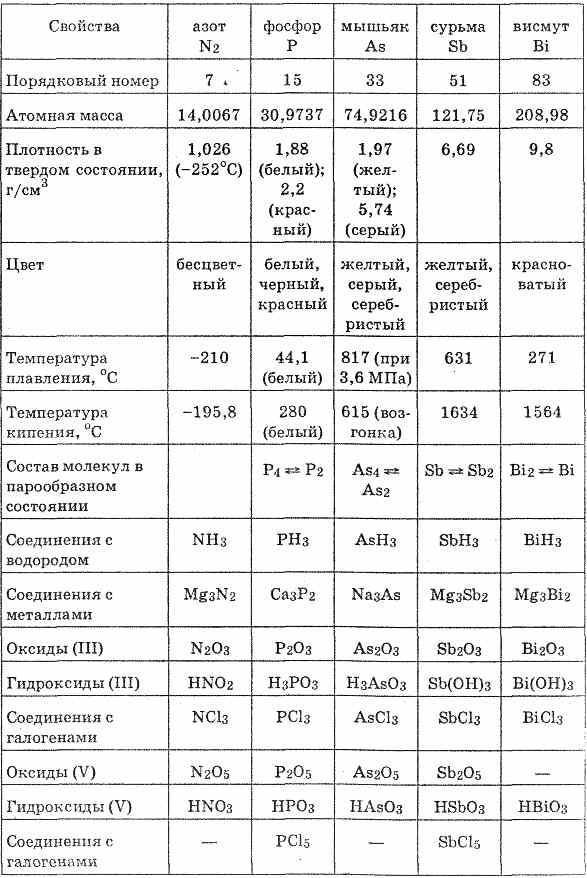
С кислородом элементы подгруппы азота образуют оксиды общей формулы R2O3 и R2O5. Оксидам соответствуют кислоты HRO2 и HRO3 (и ортокислоты H3RO4, кроме азота). В пределах подгруппы характер оксидов изменяется так: N2O3 — кислотный оксид; Р4О6 — слабокислотный оксид; As2O3 — амфотерный оксид с преобладанием кислотных свойств; Sb2O3 — амфотерный оксид с преобладанием основных свойств; Bi2O3 — основной оксид. Таким образом, кислотные свойства оксидов состава R2O3 и R2O5 уменьшаются с ростом порядкового номера элемента.
Как видно из табл. 21, внутри подгруппы от азота к висмуту убывают неметаллические свойства и возрастают металлические. У сурьмы эти свойства выражены одинаково, у висмута преобладают металлические, у азота — неметаллические свойства. Фосфор, мышьяк и сурьма образуют несколько аллотропных соединения.
Азот.
Получение
В лабораториях его можно получать по реакции разложения нитрита аммония:
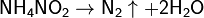
Реакция экзотермическая, идёт с выделением 80 ккал (335 кДж), поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Выделяющийся при этом газ загрязнён аммиаком, оксидом азота (I) и кислородом, от которых его очищают, последовательно пропуская через растворы серной кислоты, сульфата железа (II) и над раскалённой медью. Затем азот осушают.
Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция идёт по уравнениям:
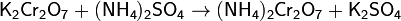
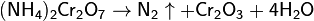
Наиболее чистый азот можно получить разложением азидов металлов:
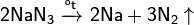
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом, при этом образуется так называемый «генераторный», или «воздушный», газ — сырьё для химических синтезов и топливо. При необходимости из него можно выделить азот, поглотив монооксид углерода.
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот». Также широко применяются азотные установки и станции, в которых используется метод адсорбционного и мембранного газоразделения.
Один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре ~700 °C:

Аммиак берут из его насыщенного раствора при нагревании. Количество CuO в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (тоже ~700 °C), затем сушат концентрированной серной кислотой и сухой щёлочью. Процесс происходит довольно медленно, но он того стоит: газ получается весьма чистый.
Дата добавления: 2016-06-22; просмотров: 11415;











