Химические свойства
Серная кислота — сильный окислитель, особенно при нагревании и в концентрированном виде; окисляет HI и частично HBr до свободных галогенов, углерод до CO2, серу — до SO2, окисляет многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до SO2, а наиболее сильными восстановителями — до S и H2S. Концентрированная H2SO4частично восстанавливается водородом, из-за чего не может применяться для его сушки. Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением. Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
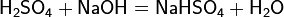
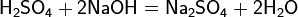
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:
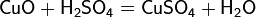
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
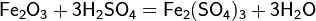
Свойства сульфитов
Средние, за исключением сульфитов щелочных металлов и аммония, малорастворимы в воде, растворяются в присутствии SO2. Из кислых в свободном состоянии выделены лишь гидросульфиты щелочных металлов. Для сульфитов в водном растворе характерны окисление до сульфатов и восстановление до тиосульфатов M2S2O3.
Реакции с повышением степени окисления серы от +4 до +6, например:
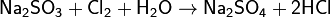
Реакции самоокисления-самовосстановления серы возможны и при ее взаимодействии с сульфитами. Так, при кипячении раствора с мелкоизмельченной серой образуется тиосульфатнатрия:
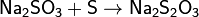
Таким образом, сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные свойства.
При нагревании гидросульфитов образуются пиросульфиты.
Дата добавления: 2016-06-22; просмотров: 2052;











