Физические свойства
Термически устойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2). Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34·10−29 Кл·м). В отличие от молекул воды, атомы водорода в молекуле не образуют прочных водородных связей, поэтому сероводород является газом. Раствор сероводорода в воде — очень слабая сероводородная кислота.
Химические свойства
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
 Ka = 6.9·10−7 моль/л; pKa = 6.89.
Ka = 6.9·10−7 моль/л; pKa = 6.89.
Реагирует с основаниями:
 (обычная соль, при избытке NaOH)
(обычная соль, при избытке NaOH)
 (кислая соль, при отношении 1:1)
(кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. На воздухе горит синим пламенем:
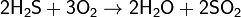
при недостатке кислорода:
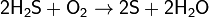 (на этой реакции основан промышленный способ получения серы).
(на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO42−, например:
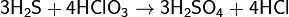
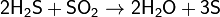
Сульфиды
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов раствора сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са²+ и Sr2+ очень нестойки. Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями (например, Al2S3, Cr2S3 и др.) часто проходит необратимо.
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь).
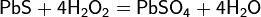
Получение
· Взаимодействием разбавленных кислот с сульфидами:
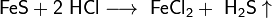
· Взаимодействие сульфида алюминия с водой (эта реакция отличается чистотой полученного сероводорода):
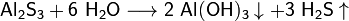
· Сплавлением парафина с серой.
Дата добавления: 2016-06-22; просмотров: 1488;











