Противоречия старой теории электролиза воды
Полезность любой теории определяется её возможностями правильно интерпретировать результаты уже существующих экспериментов и прогнозировать возможность получения новых теоретических и экспериментальных данных. Посмотрим, отвечает ли этим требованиям, старая теория электролиза воды. Для этого, проанализируем старое описание химического процесса получения водорода из воды. Оно - в многочисленных учебниках. Химические реакции, протекающие при этом процессе, используются для расчетов его параметров. Они признаются предельно ясными и не вызывают возражений как среди химиков, так и среди физиков. Посмотрим, действительно ли здесь все так ясно? Считается, что на катоде протекает следующая реакция
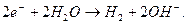 (362)
(362)
Два электрона, поступающие с катода, реагируют с двумя молекулами воды, образуя молекулу водорода 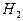 и два иона гидроксила
и два иона гидроксила 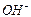 . Молекулярный водород образует пузырьки газообразного водорода, а ионы гидроксила остаются в растворе. На аноде протекает реакция
. Молекулярный водород образует пузырьки газообразного водорода, а ионы гидроксила остаются в растворе. На аноде протекает реакция
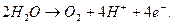 (363)
(363)
Четыре электрона переходят на анод с двух молекул воды, которая разлагается с образованием молекулы кислорода и четырех ионов водорода. Суммарную реакцию можно получить, умножая уравнение (362) на 2 и суммируя с уравнением (363). Она выглядит следующим образом
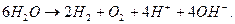 (364)
(364)
Считается также, что в кислых растворах, с высокой концентрацией ионов водорода, на катоде может протекать реакция
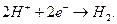 (365)
(365)
Возникает такой вопрос: что следует понимать под символом 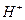 при таком учебном изложении сути процесса электролиза воды? Естественно,
при таком учебном изложении сути процесса электролиза воды? Естественно, 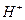 означает положительный ион атома водорода, то есть протон. Однако химики умудрились обозначить этим же символом и положительно заряженный ион гидроксония
означает положительный ион атома водорода, то есть протон. Однако химики умудрились обозначить этим же символом и положительно заряженный ион гидроксония 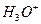 . Они давно приняли соглашение: в целях упрощения записи, писать
. Они давно приняли соглашение: в целях упрощения записи, писать 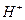 , вместо -
, вместо - 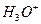 . Вот и приходится гадать: всегда ли под химическим символом
. Вот и приходится гадать: всегда ли под химическим символом 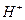 надо понимать совокупность символов
надо понимать совокупность символов 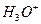 или нет? А если нет, то, как же различать случаи "да" и "нет"? Ведь символ
или нет? А если нет, то, как же различать случаи "да" и "нет"? Ведь символ 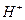 используется в многочисленных других химических реакциях.
используется в многочисленных других химических реакциях.
Если согласиться с описанным процессом электролиза воды, то из него следует, что в водном растворе существуют свободные протоны, которые обозначаются символом 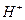 . Имея положительный заряд, они движутся к катоду и, получив от него электрон
. Имея положительный заряд, они движутся к катоду и, получив от него электрон 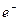 , образуют вначале атомы водорода
, образуют вначале атомы водорода 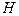 , которые, соединяясь, формируют молекулы
, которые, соединяясь, формируют молекулы 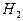 , выделяя при этом 436 кДж/моль. По-другому ведь невозможно интерпретировать формулы (362), (363), (364).
, выделяя при этом 436 кДж/моль. По-другому ведь невозможно интерпретировать формулы (362), (363), (364).
Из формулы (361) следует, что у анода идет процесс синтеза молекул кислорода из его атомов, который должен сопровождаться выделением энергии 495 кДж/моль. Это также надо учитывать при анализе энергетического баланса процесса электролиза воды, но в современной химии не принято проводить такой анализ, так как из него следуют противоречия с экспериментом. Рассмотрим одно из них.
Введем, как это и должно быть, символ 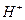 для обозначения только протона. Тогда реакция синтеза атома водорода
для обозначения только протона. Тогда реакция синтеза атома водорода 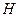 запишется так
запишется так
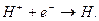 (366)
(366)
Реакция синтеза молекулы водорода представится в таком виде
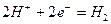 . (367)
. (367)
Гипотеза о присутствии в различных химических растворах свободных протонов атомов водорода плодотворно используется в старой химии. Однако появление плазменного электролиза воды ставит эту гипотезу под сомнение. Дело в том, что протон - это очень маленькое и очень активное образование, которое может существовать только в составе ядра атома или в составе атома водорода, выполняя роль его ядра. Атомы водорода существуют в свободном состоянии при температуре (2700...10000)  С. Это означает, что при определенной плотности атомов водорода в единице объема должна формироваться плазма с такой температурой. Но при низковольтном электролизе воды плазма атомарного водорода, как известно, не образуется. Это значит, что в этом случае отсутствуют условия существования атомов водорода в свободном состоянии, то есть условия синтеза атомов водорода.
С. Это означает, что при определенной плотности атомов водорода в единице объема должна формироваться плазма с такой температурой. Но при низковольтном электролизе воды плазма атомарного водорода, как известно, не образуется. Это значит, что в этом случае отсутствуют условия существования атомов водорода в свободном состоянии, то есть условия синтеза атомов водорода.
Известна энергия синтеза молекул водорода (436 кДж/моль), поэтому мы можем рассчитать примерное количество энергии, которое должно выделяться в электролитическом растворе при получении одного кубометра водорода в условиях, когда свободные атомы водорода объединяются в молекулы, как это следует из старой теории электролиза воды (362-365). В одном кубическом метре водорода содержится 1000/22,4=44,64 моля молекулярного водорода. При его синтезе выделяется энергия
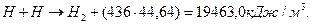 (368)
(368)
Если согласиться с наличием процесса синтеза молекул кислорода, то в зоне анода должна протекать реакция
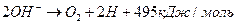 , (369)
, (369)
то есть должны формироваться молекулы кислорода и атомы 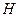 водорода. Но, как известно, при низковольтном электролизе воды в зоне анода выделяется только кислород.
водорода. Но, как известно, при низковольтном электролизе воды в зоне анода выделяется только кислород.
Известно также, что при низковольтном процессе электролиза воды формирование 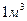 (44,64 моля) водорода сопровождается выделением 22,32 моля молекулярного кислорода. В результате этого должно выделяться 495х22,32=11048,80 кДж энергии. Складывая эту энергию с энергией синтеза молекул водорода (368), получим
(44,64 моля) водорода сопровождается выделением 22,32 моля молекулярного кислорода. В результате этого должно выделяться 495х22,32=11048,80 кДж энергии. Складывая эту энергию с энергией синтеза молекул водорода (368), получим
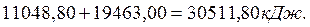 (370)
(370)
Учитывая существующие экономные затраты на получение одного кубометра водорода, равные 4кВтч или 3600х4=14400кДж, определим общий показатель тепловой энергетической эффективности 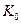 низковольтного процесса электролиза воды с учётом энергии, выделяющейся в зонах катода и анода
низковольтного процесса электролиза воды с учётом энергии, выделяющейся в зонах катода и анода
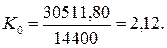 (371)
(371)
Но в реальности его нет. Тепловой энергетический показатель современного низковольтного процесса электролиза воды меньше единицы, поэтому возникает вопрос: каким образом формируются молекулы водорода и кислорода при низковольтном процессе электролиза воды, не генерируя ту энергию, которая следует из старой теории этого процесса (370 и 371)? Ответа нет. Продолжим искать его.
Дата добавления: 2016-06-22; просмотров: 3301;











