Её экспериментальная проверка
Новую теорию электролиза воды мы будем базировать не только на уравнениях химических реакций, но и на моделях атомов, ионов, молекул и кластеров, которые участвуют в этом процессе со своими давно определёнными энергетическими показателями синтеза и диссоциации ионов, молекул и кластеров воды.
Поскольку атомарный водород существует лишь при температуре 2700-10000 С, а в обычных электролизёрах такой температуры нет, то это значит, что при электролизе воды отсутствует процесс синтеза молекул водорода из его свободных атомов и сразу возникает вопрос откуда берутся молекулы водорода при электролизе воды?
Почему наши предшественники не поставили этот вопрос? Мешало орбитальное движение электронов в атомах, которое лишало возможности формирования правильных представлений о процессах соединения атомов в молекулы. Теперь мы знаем, что электроны взаимодействуют с протонами ядер не орбитально, а линейно (рис. 205).
Отсутствие орбитального движения электронов в атомах и их линейное взаимодействие с протонами ядер раскрывает структуры любых атомов, в том числе, атомов водорода (рис. 205) и кислорода (рис. 207, а), которые входят в состав молекулы воды (рис. 207, с).
Использование моделей атомов, ионов, молекул и кластеров (рис. 207, d) значительно облегчает процессы интерпретации результатов экспериментов и делает их прозрачными. Это значит, что указанные модели выполняют функции теоретического анализа результатов экспериментов и являются неотъемлемой частью теории электролиза воды.
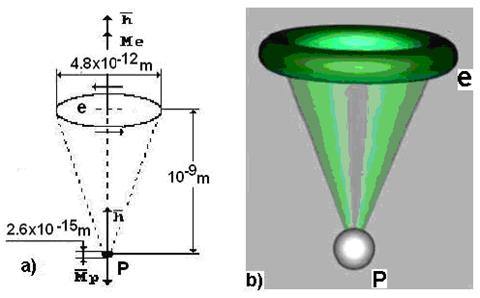
Рис. 205: а) теоретическая модель атома водорода и его размеры в
невозбуждённом состоянии; b) модель атома водорода, следующая из новой теории микромира
Обратим внимание на закономерность формирования атома водорода (рис. 205, а). Направления спинов  электрона
электрона  и протона
и протона  совпадают, а направления векторов их магнитных моментов
совпадают, а направления векторов их магнитных моментов 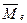 и
и 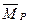 противоположны. Такая закономерность обусловлена тем, что разноимённые электрические заряды электрона и протона сближают их, а одноимённые магнитные полюса ограничивают их сближение.
противоположны. Такая закономерность обусловлена тем, что разноимённые электрические заряды электрона и протона сближают их, а одноимённые магнитные полюса ограничивают их сближение.
Эти логические действия Природы реализуются при образовании первой структуры молекулы ортоводорода (рис. 206, а). Электростатические силы взаимного притяжения первого электрона и первого протона (рис. 206, а) уравновешиваются противоположно направленными магнитными силами этих частиц. Именно поэтому векторы 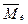 и
и 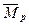 их магнитных моментов направлены противоположно. Электростатические силы отталкивания, действующие между первым и вторым электронами, уравновешиваются сближающими их магнитными силами, поэтому направления векторов
их магнитных моментов направлены противоположно. Электростатические силы отталкивания, действующие между первым и вторым электронами, уравновешиваются сближающими их магнитными силами, поэтому направления векторов 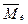 обоих электронов совпадают (рис. 206, а).
обоих электронов совпадают (рис. 206, а).
Рис. 206. Схема молекулы водорода  :
:
а), b) - ортоводород; c) - параводород
Чтобы скомпенсировать электростатические силы взаимного притяжения второго электрона и второго протона, необходимо сделать магнитные силы этих частиц противоположно направленными. Это действие отражено в противоположно направленных векторах  и
и 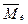 магнитных моментов второго протона и второго электрона (рис. 206, а, слева) первой модели молекулы водорода.
магнитных моментов второго протона и второго электрона (рис. 206, а, слева) первой модели молекулы водорода.
На рис. 206, b показан еще один вариант компоновки молекулы ортоводорода. Принцип формирования этой молекулы тот же. Векторы магнитных моментов электронов и протонов оказываются направленными так, что если электрические силы приближают частицы, то магнитные силы должны удалять их друг от друга.
В результате между этими силами устанавливается равновесие. Устойчивость образовавшейся таким образом структуры зависит от энергий связи между ее элементами. Поскольку магнитные моменты электронов на два порядка больше магнитных моментов протонов, то электромагнитные силы первой структуры (рис. 206, а) прочнее удерживают ее элементы вместе, чем в структуре, показанной на рис. 206, b, поэтому есть основания ожидать, что первая структура ортоводорода (рис. 206, а) устойчивее второй (рис. 206, b).
При образовании молекулы параводорода (рис. 206, c) логика формирования связи между первым электроном 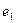 и первым (справа) протоном
и первым (справа) протоном 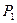 остается прежней. Далее, силы взаимного притяжения первого электрона
остается прежней. Далее, силы взаимного притяжения первого электрона 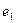 и первого протона
и первого протона 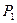 , а также второго электрона
, а также второго электрона 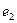 и второго протона
и второго протона 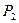 уравновешиваются их противоположно направленными магнитными силами. Поскольку векторы магнитных моментов электрона и протона, расположенных на краях этой структуры, направлены противоположно, то общий магнитный момент такой структуры близок к нулю (рис. 206, с). Поэтому посчитали, что векторы магнитных моментов протонов у такой структуры направлены противоположно и назвали её параводородом.
уравновешиваются их противоположно направленными магнитными силами. Поскольку векторы магнитных моментов электрона и протона, расположенных на краях этой структуры, направлены противоположно, то общий магнитный момент такой структуры близок к нулю (рис. 206, с). Поэтому посчитали, что векторы магнитных моментов протонов у такой структуры направлены противоположно и назвали её параводородом.
Отметим ещё раз: атомарный водород (рис. 205, а и b) существует в плазменном состоянии при температуре 2700-10000 С. Если бы образование молекул водорода при электролизе воды шло путем отделения атомов водорода от молекул воды, которые в этом случае имели бы фазы свободного состояния, то в фазе атомарного состояния водорода в электролитическом растворе формировалась бы указанная температура, но её нет, поэтому у нас появляются основания предположить, что молекулы водорода выделяются из кластеров воды в синтезированном состоянии. Для проверки достоверности такого предположения, надо владеть информацией о структурах атома и молекулы кислорода (рис. 207, а и b).
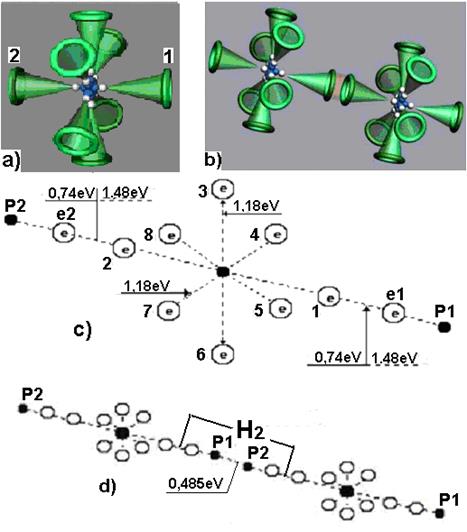
Рис. 207: а) модель атома кислорода; b) модель молекулы кислорода
с) схема молекулы воды: 1,2,3,4,5,6,7,8 - номера электронов атома кислорода; 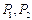 - ядра атомов водорода (протоны);
- ядра атомов водорода (протоны); 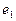 и
и 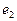 - номера электронов атомов водорода d) кластер из двух молекул воды
- номера электронов атомов водорода d) кластер из двух молекул воды
Самая главная особенность структуры атома кислорода в том, что два электрона 1 и 2 (рис. 207, а) расположены на оси его атома, а шесть остальных – по кругу, перпендикулярному оси. Можно предположить, что суммарное электростатическое поле шести электронов, расположенных по кругу (назовем их кольцевыми электронами), удаляет 1-й и 2-й осевые электроны на большее расстояние от ядра атома, чем то расстояние от ядра атома, на котором распложены кольцевые электроны (3, 4, 5, 6, 7 и 8). Осевые электроны (1 и 2) атома кислорода являются его главными валентными электронами. При образовании молекулы воды (рис. 207, с) электроны атомов водорода (рис. 198, а и b) присоединяются к осевым электронам атома кислорода (рис. 207, а), образуя молекулу воды (рис. 207, с).
Электроны атомов водорода обозначены на рис. 207, с символами 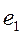 и
и 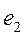 , а протоны атомов водорода - символами
, а протоны атомов водорода - символами 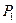 и
и 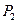 (рис. 207, с и d). Структура атома водорода (рис. 205, а и b) показывает, что если этот атом соединится с 1-м и 2-м осевым электроном атома кислорода своим единственным электроном, то протоны
(рис. 207, с и d). Структура атома водорода (рис. 205, а и b) показывает, что если этот атом соединится с 1-м и 2-м осевым электроном атома кислорода своим единственным электроном, то протоны 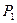 и
и 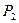 окажутся на концах оси молекулы и образуют зоны с положительными зарядами (рис. 207, с).
окажутся на концах оси молекулы и образуют зоны с положительными зарядами (рис. 207, с).
Отрицательно заряженную зону сформируют электроны атома кислорода, расположенные по кольцу вокруг оси атома кислорода (рис. 207, с). Такая модель структуры молекулы воды объясняет увеличение её объёма при замерзании.
Поскольку при охлаждении электроны излучают фотоны и приближаются к ядру атома, то шесть кольцевых электронов (3, 4, 5, 6, 7 и 8) атома кислорода в молекуле воды, приближаясь к ядру атома, своим суммарным статическим электрическим полем удаляют осевые электроны 1 и 2 от ядра (рис. 207, с). В этом случае расстояние между атомами водорода, расположенными на оси молекулы воды и её кластера (рис. 207, с и d), увеличиваются. Это и есть главная причина увеличения размеров молекул воды при их замерзании.
Обратим внимание на то, что кластеры воды формируются, прежде всего, протон - протонными связями, когда две её молекулы соединяются соосно (рис. 207, d). Если учесть, что размер протона на три порядка меньше размера электрона, то протон – протонная связь легче разрушается при механическом воздействии на такой кластер (рис. 207, d), обеспечивая текучесть воды.
Большое электрическое сопротивление чистой, дисцилированой воды обусловлено тем, что на осевых концах молекул располагаются положительно заряженные протоны атомов водорода. В результате линейные кластеры молекул воды имеют на обоих концах одноимённые заряды, что исключает возможность формирования электрической цепи в чистой воде и увеличивает её электрическое сопротивление.
Чтобы уменьшить электрическое сопротивление воды и увеличить её электропроводность, надо ввести в чистую воду ионы, которые имели бы на одном конце главной оси электрон, а на другом - протон. В этом случае такие ионы легко объединяются в линейные кластеры с разными знаками электрических зарядов на их концах, что и приводит к формированию электрических цепей в растворе с разноимёнными знаками на концах, которые увеличивают его электропроводность. В качестве примера можно рассмотреть присутствие в воде иона 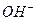 (рис. 208, а и b).
(рис. 208, а и b).
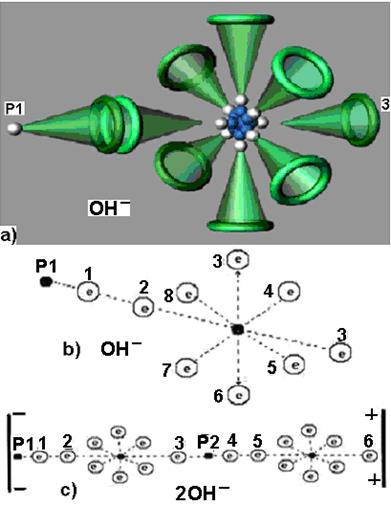
Рис. 208. Схемы: а) гидроксила 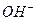 ; b) кластера
; b) кластера 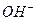
Известно, что вода может обладать щелочными или кислотными свойствами. Щелочные свойства формируются за счет увеличенного содержания в воде гидроксила 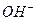 , например, (рис. 208, а и b). На рис. 208, а представлена модель гидроксила, а на рис. 208, b - схема гидроксила.
, например, (рис. 208, а и b). На рис. 208, а представлена модель гидроксила, а на рис. 208, b - схема гидроксила.
На одном конце оси гидроксила 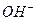 расположен электрон 3 атома кислорода, а на другом - протон
расположен электрон 3 атома кислорода, а на другом - протон 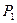 атома водорода. Таким образом, гидроксил – идеальное звено электрической цепи. Под действием приложенного напряжения ионы гидроксила формируют линейные кластеры с положительным и отрицательным знаками электрических зарядов на их концах (рис. 208, с). В результате электрический импульс напряжения передаётся в растворе вдоль таких кластеров.
атома водорода. Таким образом, гидроксил – идеальное звено электрической цепи. Под действием приложенного напряжения ионы гидроксила формируют линейные кластеры с положительным и отрицательным знаками электрических зарядов на их концах (рис. 208, с). В результате электрический импульс напряжения передаётся в растворе вдоль таких кластеров.
На рис. 209, а представлен кластер из молекулы воды 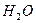 и иона гидроксила
и иона гидроксила 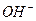 (рис. 209, b). Электрон
(рис. 209, b). Электрон 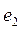 иона
иона 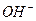 ориентирован к аноду (+), а протон
ориентирован к аноду (+), а протон 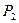 атома водорода молекулы воды – у катода (-). В структуре этого кластера присутствует молекула ортоводорода
атома водорода молекулы воды – у катода (-). В структуре этого кластера присутствует молекула ортоводорода 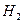 . Если она выделится из кластера, то у анода останется атом кислорода
. Если она выделится из кластера, то у анода останется атом кислорода 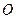 , а у катода – ион
, а у катода – ион 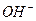 (рис. 209, е), который соединится со следующей молекулой воды и процесс разложения её на молекулы водорода и атомы кислорода продолжится.
(рис. 209, е), который соединится со следующей молекулой воды и процесс разложения её на молекулы водорода и атомы кислорода продолжится.
Итак, анализ процесса электролиза воды (рис. 209) показывает, что для его реализации требуется только электрический потенциал между анодом и катодом и не требуются электроны из сети. Это значит, что описанный процесс электролиза может идти без специальных посторонних источников энергии. И он идёт ежегодно при фотосинтезе. Учёные установили, что в процессе фотосинтеза на планете Земля ежегодно формируется около 800 миллионов кубических метров молекулярного водорода.
Обратим внимание на энергии химических связей между атомами в кластере 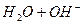 на рис. 209. Наибольшая энергия связи 4,53eV между протонами атомов водорода в молекуле ортоводорода
на рис. 209. Наибольшая энергия связи 4,53eV между протонами атомов водорода в молекуле ортоводорода 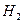 , а наименьшая энергия связи 1,48eV между электроном
, а наименьшая энергия связи 1,48eV между электроном 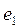 молекулы воды и электроном
молекулы воды и электроном 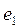 молекулы ортоводорода
молекулы ортоводорода 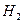 (рис. 209, с). Это обеспечивает выделение молекулы ортоводорода
(рис. 209, с). Это обеспечивает выделение молекулы ортоводорода 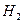 и атома кислорода
и атома кислорода 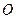 в свободное состояние (рис. 209).
в свободное состояние (рис. 209).
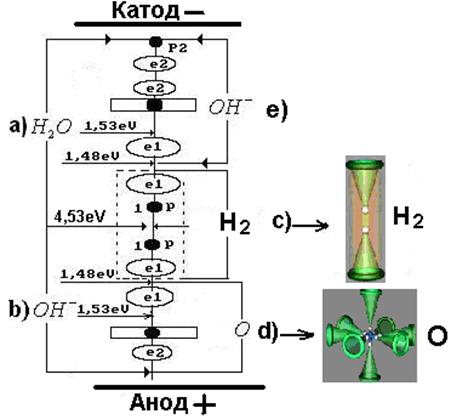
Рис. 209. Схема выделения молекулы ортоводорода 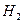 и атома
и атома
кислорода 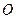 из кластера
из кластера 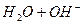 молекулы воды
молекулы воды 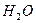 и иона
и иона 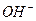
В табл. 54 и 55 представлены спектры первых электронов атомов водорода и кислорода. В ряду энергий связей 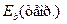 электрона с протоном атома водорода (табл. 54) и валентного электрона атома кислорода с протоном его ядра (табл. 55) есть энергии связи (1,51eV) и (1,53 eV), при которых начинается и идет процесс выделения газов в процессе электролиза воды. Раньше, из анализа процесса синтеза молекулы воды, мы установили, что энергия связи между электронами атомов водорода и кислорода в молекуле воды равна 1,48eV (рис. 209, а и b).
электрона с протоном атома водорода (табл. 54) и валентного электрона атома кислорода с протоном его ядра (табл. 55) есть энергии связи (1,51eV) и (1,53 eV), при которых начинается и идет процесс выделения газов в процессе электролиза воды. Раньше, из анализа процесса синтеза молекулы воды, мы установили, что энергия связи между электронами атомов водорода и кислорода в молекуле воды равна 1,48eV (рис. 209, а и b).
Таблица 54. Спектр атома водорода
| Значения | n | |||||
 (эксп) (эксп)
| eV | 10,20 | 12,09 | 12,75 | 13,05 | 13,22 |
 (теор) (теор)
| eV | 10,198 | 12,087 | 12,748 | 13,054 | 13,220 |
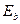 (теор) (теор)
| eV | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 |
Таблица 55. Спектр первого электрона атома кислорода
| Значения | n | |||||
 (эксп.) (эксп.)
| eV | 10,18 | 12,09 | 12,76 | 13,07 | 13,24 |
 (теор.) (теор.)
| eV | 10,16 | 12,09 | 12,76 | 13,07 | 13,24 |
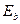 (теор.) (теор.)
| eV | 3,44 | 1,53 | 0,86 | 0,55 | 0,38 |
Итак, среди энергий связи электрона атома водорода с его ядром (протоном) есть энергия (1,51 eV), близкая к экспериментальному значению (1,48 eV). Определим аналогичные энергии для электронов атома кислорода. Поскольку в химических реакциях участвуют, в основном, поверхностные электроны атомов, которые имеют близкие значения энергий связи с ядрами атомов на одноименных энергетических уровнях, то ограничимся анализом энергий связи первого электрона атома кислорода (табл. 55).
Как видно (табл. 55), энергии связи 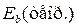 первого электрона
первого электрона 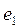 атома кислорода, соответствующим третьему (n=3) энергетическому уровню, практически совпадает с соответствующей энергией связи электрона
атома кислорода, соответствующим третьему (n=3) энергетическому уровню, практически совпадает с соответствующей энергией связи электрона 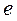 атома водорода (табл. 54). Причем, энергия, соответствующая третьему уровню (1,53 eV), близка к экспериментальному значению энергии (1,48 eV) газовыделения при низковольтном электролизе воды (рис. 209. Так что теоретические значения энергий связи электрона первого атома водорода и первого электрона
атома водорода (табл. 54). Причем, энергия, соответствующая третьему уровню (1,53 eV), близка к экспериментальному значению энергии (1,48 eV) газовыделения при низковольтном электролизе воды (рис. 209. Так что теоретические значения энергий связи электрона первого атома водорода и первого электрона 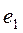 атома кислорода в молекуле воды, полученные на основании закона формирования спектров близки к экспериментальным значениям 1,48eV этой энергии (табл. 54 и 55).
атома кислорода в молекуле воды, полученные на основании закона формирования спектров близки к экспериментальным значениям 1,48eV этой энергии (табл. 54 и 55).
Теперь у нас появились веские основания полагать, что первый электрон атома кислорода, устанавливая связь с электроном 1-го атома водорода в молекуле воды, находится вблизи третьего ( 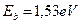 ) энергетического уровня (табл. 55).
) энергетического уровня (табл. 55).
Анализируя закономерность изменения энергий связи электронов атома кислорода и других атомов с их ядрами, мы установили, что в условиях присутствия в атоме всех электронов они имеют, примерно, одинаковые энергии связи с протонами ядер атомов. Поэтому будем считать, что симметричность молекулы воды обеспечивает равные (или близкие) энергии связи с ядром его 1-го и 2-го электронов (рис. 208, а).
Низковольтный процесс электролиза воды обычно идет при напряжении (1,6 - 2,3)B и достаточно большой силе тока, свидетельствующей о большом расходе электронов из электрической сети.
Энергия синтеза одного моля молекул водорода равна 436кДж. Переведем её в электрон-вольты в расчете на одну молекулу.
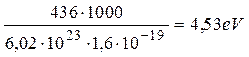 . (376)
. (376)
Величина этой энергии показана слева от молекулы водорода, расположенной в кластерной цепочке (рис. 209, a и b). Показаны энергии связи 1,48eV атомов водорода с атомами кислорода в молекулах воды. Энергия 4,53eV синтеза молекулы водорода перераспределяет энергии связи в кластерной цепочке таким образом, что энергии 1,48eV связи атомов водорода с атомами кислорода в молекулах воды уменьшаются почти до нуля и молекула ортоводорода 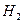 выделяется из кластерной цепочки (рис. 209, с).
выделяется из кластерной цепочки (рис. 209, с).
Таким образом, разность между энергией 4,53eV синтеза молекулы водорода и суммарной энергией связи (1,48+1,48) = 2,96 eV оказывается равной (4,53 – 2,96)=1,57eV. Эта энергия расходуется на нагревание электролитического раствора. Поэтому при выделении  водорода выделится не 44,64х436=19463 кДж, предсказываемых старой теорией электролиза, а следующее количество тепловой энергии
водорода выделится не 44,64х436=19463 кДж, предсказываемых старой теорией электролиза, а следующее количество тепловой энергии
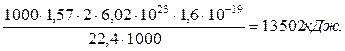 (377)
(377)
При этом у катода идёт химическая реакция
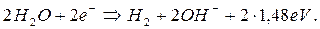 (378)
(378)
А теперь учтём, что существующие счётчики электроэнергии и другие электроизмерительные приборы правильно учитывают расход электроэнергии из сети  только при непрерывном её потреблении и при постоянном напряжении на клеммах электролизёра и завышают её расход при импульсном напряжении, подаваемом на клеммы электролизёра, в количество раз, равное скважности импульсов
только при непрерывном её потреблении и при постоянном напряжении на клеммах электролизёра и завышают её расход при импульсном напряжении, подаваемом на клеммы электролизёра, в количество раз, равное скважности импульсов  , которая может меняться в интервале (1….100).
, которая может меняться в интервале (1….100).
При непрерывном напряжении на клеммах электролизёра количество тепловой энергии 13502кДж является частью общей энергии 4х3600 = 14400 кДж, расходуемой на получение одного кубического метра водорода. Показатель тепловой эффективности (КПД) этого процесса окажется таким
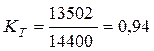 . (379)
. (379)
Важно иметь в виду, что энергию синтеза молекул кислорода мы не учли. Если же учитывать энергию синтеза молекул кислорода, то надо знать, сколько кислорода выделятся при получении 1000 литров водорода. Известно, что из одного литра воды можно получить 1234,44 литра водорода и 604,69 литра кислорода. Тогда при выделении 1000 литров водорода выделится 60469/1234,4=489,86 литра кислорода. Учитывая, что энергия, выделяющаяся при синтезе одной молекулы кислорода, равна 4,95 eV (5,13 кДж/моль), найдем количество энергии, которая выделится при синтезе 489,86 литров кислорода.
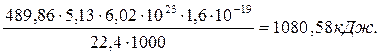 (380)
(380)
Тогда общий показатель тепловой эффективности (КПД) будет равен
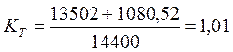 . (381)
. (381)
Таким образом, показатель общей тепловой эффективности (381) существующего низковольтного процесса электролиза воды близок к единице, поэтому считали, что энергобаланс процесса электролиза воды подчинялся закону сохранения энергии.
Однако, если учесть, что энергосодержание одного грамма водорода равно 142 кДж, а кубический метр этого газа весит 90 гр., то показатель общей энергетической эффективности (КПД) будет таким
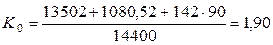 (382)
(382)
Возникает вопрос: а нельзя ли смоделировать электролитический процесс разложения воды на водород и кислород, который идет при фотосинтезе? Анализ структуры молекулы воды (рис. 207, с), выявленной нами, и кластера из двух молекул воды (рис. 207, d) показывает, что в этом кластере есть молекула ортоводорода (рис. 207, d). Это указывает на то, что эта молекула выделяется из кластера молекул воды при фотосинтезе, который идёт при минимальном токе.
На рис. 207, с представлена схема молекулы воды с энергиями связи между атомами водорода и кислорода в условиях, когда молекула воды находится в нейтральной среде, без ионов щелочи или кислоты, а также без электрического потенциала, который бы действовал на такие ионы.
Поиск условий разложения воды на водород и кислород, который идет при фотосинтезе, привел нас к простой конструкции ячейки, в которой имитированы годовые кольца стволов деревьев в виде зазоров между коническими электродами.
Дата добавления: 2016-06-22; просмотров: 3298;











