Молекул кислорода, водорода и воды
В инженерной практике по обслуживанию вентиляционных систем обнаружено появление избыточной тепловой энергии в циркулирующем воздухе. Аналогичное явление зафиксировано и в системах циркуляции воды с устройствами для её активной кавитации. Результаты наших исследований не только объясняют причину этих явлений, но позволяют делать количественные расчеты энергетических процессов, генерирующих дополнительную тепловую энергию.
Атом кислорода – восьмой элемент периодической таблицы химических элементов, расположенный в её шестой группе. Структура атома и его ядра показаны на рис. 102, а. Наименьшая энергия ионизации первого валентного электрона атома кислорода равна 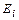 = 13,618 eV, а энергия его связи с ядром атома, соответствующая первому энергетическому уровню, -
= 13,618 eV, а энергия его связи с ядром атома, соответствующая первому энергетическому уровню, - 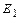 =13,752 eV. Другие энергии связи этого электрона с ядром атома приведены в табл. 26, 27.
=13,752 eV. Другие энергии связи этого электрона с ядром атома приведены в табл. 26, 27.
Известно, что процесс синтеза молекул кислорода сопровождается выделением 495 кДж/моль энергии или в расчете на одну молекулу
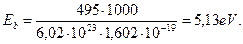 (230)
(230)
Каким же принципом руководствуется Природа, распределяя энергию 5,13 eV между электронами молекулы кислорода (рис. 116, а)?
Энергия 5,13 eV – термическая энергия связи между электронами 1 и 2’ двух атомов кислорода (рис. 116, а). При образовании молекулы кислорода эта энергия излучается в виде фотонов электронами, вступающими в связь. Из этого следует, что она равна сумме энергий двух фотонов, излучённых этими электронами. Следовательно, каждый электрон, вступающий в контакт, излучает по фотону с энергиями 5,13/2=2,565eV (рис. 116, b). Согласно табл. 24 валентные электроны в этом случае занимают положения между вторым и третьим энергетическими уровнями.
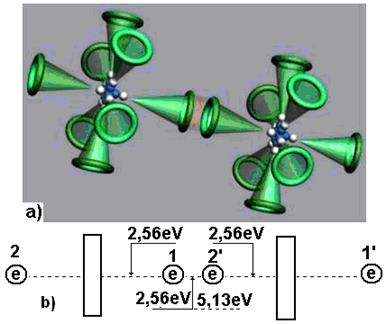
Рис. 116. Схема распределения энергий связи между
электронами в молекуле кислорода
Два атома кислорода соединяются в молекулу в состоянии возбуждения. Состоянием возбуждения атома считается такое его состояние, при котором его валентные электроны удалены от ядер на такие расстояния, когда энергия связи между ними уменьшается до тысячных долей электрон-вольта. В этом случае атом может потерять электрон и стать свободным. Или, не теряя электроны, он соединяется своим валентным электроном с электроном соседнего атома и начинается процесс формирования молекулы кислорода. Это – экзотермический процесс, при котором осевые валентные электроны 1 и 2’, излучая фотоны и опускаясь на более низкие энергетические уровни, выделяют  = 2,565х2=5,13 eV.
= 2,565х2=5,13 eV.
Обратим внимание на то, что термическая энергия 5,13 eV выделяется двумя электронами, формирующими электродинамическую связь с энергией 2,56 eV. В современной химии эта связь называется ковалентной. Для её разрушения достаточно затратить 2,56 eV механической энергии. Для термического разрыва этой связи энергии требуется в два раза больше, то есть 5,13 eV. Это объясняется тем, что энергия фотона 5,13 eV поглощается одновременно двумя электронами. Только в этом случае оба электрона будут переведены на самые высокие энергетические уровни с минимальной энергией электродинамической связи, при которой они разъединяются, и каждый атом кислорода становится свободным.
Таким образом, затраты энергии на разрушение молекулы кислорода зависят от способа воздействия на связь. При термическом воздействии на связь она разрушается при энергии 5,13 eV. При механическом воздействии на связь достаточно затратить 2,56 eV энергии, чтобы разрушить эту связь. Из этого следует, что энергетика процесса синтеза молекулы кислорода зависит от способа её разрушения.
После термического разрушения молекулы кислорода процесс её формирования начинается с излучения обоими валентными электронами по фотону с энергиями 2,56 eV и прежняя электродинамическая энергия связи (2,56 eV) между электронами обоих атомов восстанавливается.
Таким образом, при термическом разрушении молекулы кислорода тепловой энергии затрачивается столько же, сколько выделяется при последующем её синтезе. Никакой дополнительной энергии при термической диссоциации молекулы кислорода и последующем её синтезе не появляется.
Если же молекулу кислорода разрушать механическим путем, то для этого достаточно затратить 2,56 eV механической энергии. При этом валентные электроны атомов кислорода оказываются в свободном состоянии при недостатке энергии, соответствующей такому состоянию, так как процесс поглощения каждым из них 2,56 eV энергии отсутствовал. В таком состоянии электроны не могут оставаться, они должны немедленно восполнить энергию, которую они не получили при механическом разрыве связи между ними. Где они возьмут её? Источник один – окружающая среда, то есть физический вакуум, заполненный эфиром. Они немедленно поглощают эфир, восстанавливая свою массу, эквивалентную энергии 2,56 eV.
Следующая фаза – повторное соединение двух атомов кислорода, валентные электроны которых пополнили запасы своей энергии за счет эфира. Этот процесс сопровождается излучением двумя электронами фотонов с энергиями 2,56 eV. Так энергия поглощенного эфира преобразуется в тепловую энергию фотонов. Затратив 2,56 eV механической энергии на разрушение молекулы кислорода, при последующем синтезе этой молекулы мы получаем энергии в два раза больше (2,56x2=5,13 eV). Дополнительная энергия оказывается равной 2,56 eV на одну молекулу или 248 кДж/моль.
Существует немало экспериментальных данных, показывающих, что в вентиляционных системах тепловая энергия циркулирующего воздуха превосходит электрическую энергию, затраченную на привод вентиляторов. Теперь мы знаем, что эта энергия генерируется при механическом разрушении ковалентных связей в молекулах газов, из которых состоит воздух. Таким образом, главный источник дополнительной тепловой энергии в вентиляционных системах – эфир.
Используя изложенную методику, проанализируем энергетику молекулы воды, которая также в ряде случаев генерирует дополнительную тепловую энергию. Молекула воды состоит из одного атома кислорода и двух атомов водорода. Энергии связи 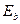 атомов водорода с его ядром представлены в табл. 7.
атомов водорода с его ядром представлены в табл. 7.
Известно, что соединение водорода с кислородом происходит в большинстве случаев со взрывом, но причина этого до сих пор не известна. Попытаемся найти её. Энергия синтеза молекулы водорода равна 436кДж/моль или 4,53eV на одну молекулу. Поскольку молекула состоит из двух атомов, то указанная энергия распределяется между ними. Таким образом, энергия одной связи между атомами водорода оказывается равной 2,26eV (рис. 81). При термическом разрушении этой связи энергии потребуется в два раза больше, а именно 2,26х2=4,53 eV.
Обратим внимание на то, что на рис. 81 два атома водорода образуют молекулу водорода, формируя три связи. Создаётся впечатление, что на одну связь должна приходиться энергия 4,53/3=1,51eV. Эта величина равна энергии связи электрона атома водорода (табл. 7) в момент пребывания его на третьем энергетическом уровне и близка к энергии связи 1,53eV первого электрона атома кислорода (табл. 23) в момент пребывания его также на третьем энергетическом уровне.
Для образования двух молекул воды необходимо разрушить на атомы две молекулы водорода и одну молекулу кислорода. Если процессы разрушения указанных молекул проводить термическим путем, то на разрушение двух молекул водорода потребуется 4,53+4,53=9,06eV, а на разрушение одной молекулы кислорода - 5,13eV. В сумме это составит 14,19eV.
Известно, что при синтезе одного моля воды выделяется 285,8 кДж или  на одну молекулу. Так как молекула воды состоит из одного атома кислорода и двух атомов водорода, то на одну связь приходится 2,96/2=1,48eV термической энергии (рис. 117). Из этого следует, что электроны атомов водорода и кислорода в молекуле воды находятся при обычной температуре (1,48/2=0,74eV) между четвертыми и пятыми энергетическими уровнями (табл. 7, 23).
на одну молекулу. Так как молекула воды состоит из одного атома кислорода и двух атомов водорода, то на одну связь приходится 2,96/2=1,48eV термической энергии (рис. 117). Из этого следует, что электроны атомов водорода и кислорода в молекуле воды находятся при обычной температуре (1,48/2=0,74eV) между четвертыми и пятыми энергетическими уровнями (табл. 7, 23).
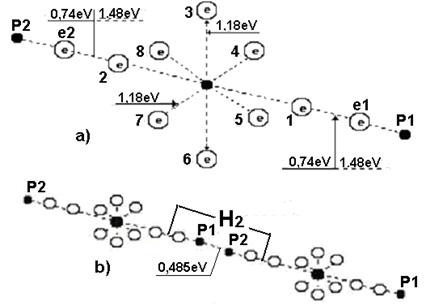
Рис. 117. Схема молекулы воды: 1,2,3,4,5,6,7,8 - номера
электронов атома кислорода; 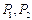 - ядра атомов водорода (протоны);
- ядра атомов водорода (протоны);  и
и 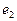 - номера электронов атомов водорода
- номера электронов атомов водорода
Таким образом на разрушение двух молекул водорода и одной молекулы кислорода термическим путем расходуется 14,19eV, а в результате синтеза двух молекул воды выделяется 2,96х2=5,98eV. Это противоречит тому факту, что процесс синтеза молекулы воды является экзотермическим с выделением 2,96 eV одной молекулой. Приведенный же расчет указывает на то, что при синтезе одной молекулы воды поглощается (14,19-5,98)/2 = 4,10 eV. В чем причина этого противоречия?
При переходе из газообразного в жидкое состояние атом кислорода в молекуле воды должен уменьшить свой объём. Это произойдет, если кольцевые электроны атома кислорода опустятся на более низкие энергетические уровни (ближе к ядру). При этом они обязательно излучат фотоны, и мы уже знаем их общую энергию. Она равна энергии, затраченной на разрушение двух молекул водорода и одной молекулы кислорода, то есть - 14,19eV. Поскольку у двух молекул воды 12 кольцевых электронов, то каждый из них излучит 14,19/12=1,18eV (рис. 117). Это больше энергии (0,74 eV) связи с ядром осевых электронов и указывает на то, что кольцевые электроны расположены ближе к ядру, чем осевые.
В этом случае количество энергии, полученной в результате синтеза двух молекул воды (14,19+5,98)eV, оказывается больше энергии, затраченной на разрушение двух молекул водорода (9,06 eV) и одной молекулы кислорода (5,13 eV). Сформировавшаяся разность энергий 5,98 eV разделится между двумя молекулами воды. На одну молекулу приходится 5,98/2=2,99 eV или 285,8 кДж/моль, что полностью соответствует существующим экспериментальным данным.
Изложенное выше проясняет причину взрыва при соединении водорода с кислородом. Одновременный переход шести кольцевых электронов каждого атома кислорода в рождающихся молекулах воды на более низкие энергетические уровни сопровождается одновременным излучением фотонов, объём которых на 5-6 порядков больше объёмов электронов, излучивших их. В результате и генерируется явление взрыва.
Обратим внимание на то, что на рис. 117, b показаны две энергии связи между валентными электронами e2 и 2, а также между 1 и e1. Энергия одной электродинамической связи равна 0,74 eV. Если эту связь разрушать термическим путем, то потребуется 0,74х2=1,48 eV. Эта же энергия выделится при последующем синтезе молекулы воды из атома водорода 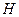 и иона гидроксила
и иона гидроксила 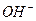 . Дополнительная тепловая энергия в этом случае не генерируется.
. Дополнительная тепловая энергия в этом случае не генерируется.
Однако, если указанную связь разрушать механическим путем, затрачивая по 0,74 eV на каждую связь, то после её разрыва у каждого электрона образуется дефицит энергии, равный 0,74 eV. Эта энергия будет немедленно поглощена из окружающей среды и излучена в виде фотона при повторном синтезе молекулы воды из атома водорода 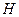 и иона гидроксила
и иона гидроксила 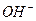 . Так одна ковалентная химическая связь при механическом разрушении молекулы воды формирует 0,74 eV дополнительной тепловой энергии, которая, как мы уже отметили, устойчиво регистрируется в системах кавитации воды.
. Так одна ковалентная химическая связь при механическом разрушении молекулы воды формирует 0,74 eV дополнительной тепловой энергии, которая, как мы уже отметили, устойчиво регистрируется в системах кавитации воды.
Известно, что молекулы воды, объединяясь, формируют кластеры. Механическое разрушение связей между кластерами и последующий синтез этих связей также должен сопровождаться выделением дополнительной тепловой энергии.
Источником дополнительной энергии является субстанция физического вакуума, которую мы называем эфиром. Электроны кластеров извлекают эту энергию из физического вакуума после механического разрушения их связей и выделяют её в виде фотонов при последующем синтезе ионов, молекул и кластеров.
Кластеры воды
Известно, что молекулы воды могут соединяться друг с другом, образуя целые ассоциации, которые называются кластерами. Кластеры - это совокупность одноименных молекул и ионов, соединенных между собой, как раньше считалось, водородными связями. И это действительно так. Молекулы воды могут соединять в кластеры протоны атомов водорода (рис. 118).
Теперь мы можем назвать их протон - протонные связи. Вот как записывается химическая формула кластера, состоящего из  ионов
ионов 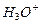 и молекул воды
и молекул воды
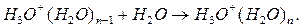 (231)
(231)
При участии иона 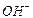 реакция протекает так
реакция протекает так
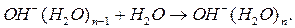 (232)
(232)
На рис. 118 показаны теоретические (рис. 118, а, b) и экспериментальные (рис. 118, с, d, e) кластеры молекул воды, полученные японскими исследователями. Существуют и экспериментальные данные энергий связи между молекулами воды и ионами 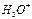 и
и 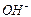 при разном их количестве в линейном кластере (рис. 118, а и табл. 39).
при разном их количестве в линейном кластере (рис. 118, а и табл. 39).
Таблица 39. Значения энергий связи в кластерах, 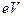
| Знач. n | 0-1 | 1-2 | 2-3 | 3-4 | 4-5 | 5-6 | 6-7 |

| 1,56 | 0,97 | 0,74 | 0,67 | 0,57 | 0,51 | 0,45 |
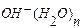
| 1,10 | 0,71 | 0,66 | 0,62 | 0,61 | - | - |
В современной химии принято считать, что процесс образования кластеров воды эндотермический, то есть при образовании кластеров электроны, соединяющие молекулы друг с другом, поглощают фотоны и удаляются от ядер атомов в своих ячейках. Например, при n=7 на образование кластера 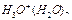 (табл. 39) затрачивается (1,56+0,97+0,74+0,67+0,57+0,51+0,45)=5,47 eV.
(табл. 39) затрачивается (1,56+0,97+0,74+0,67+0,57+0,51+0,45)=5,47 eV.
Имея структуры молекул воды (рис. 109-113, 114), мы видим и другие возможности образования кластеров. Нет никаких ограничений для формирования протон - протонных связей между молекулами воды. Так, протоны атомов водорода в молекулах воды, соединяясь, друг с другом, образуют ассоциацию из двух и более молекул (рис. 118, а).
Кроме того, ионы 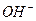 (рис. 113) могут сформировать три протон-протонных связи с молекулой воды.
(рис. 113) могут сформировать три протон-протонных связи с молекулой воды.
В этот процесс могут вовлекаться и протоны вторых атомов водорода в молекуле воды и протоны ионов 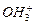 (рис. 114), а также кольцевые электроны атомов кислорода в молекуле воды. В результате количество молекул в кластере увеличивается, а структура кластера усложняется (рис. 118, a, b, c, d, e).
(рис. 114), а также кольцевые электроны атомов кислорода в молекуле воды. В результате количество молекул в кластере увеличивается, а структура кластера усложняется (рис. 118, a, b, c, d, e).
Таким образом, для образования кластеров воды совершенно не обязательно присутствие в ней ионов гидроксила 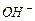 и гидроксония
и гидроксония 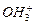 . Обратим внимание на структуру молекулы ортоводорода на рис. 111, b. Она может быть связующим звеном в кластере и после его разрушения водород может рождаться сразу не в атомарном, а в молекулярном состоянии. Именно это происходит при явлении кавитации или при фотосинтезе.
. Обратим внимание на структуру молекулы ортоводорода на рис. 111, b. Она может быть связующим звеном в кластере и после его разрушения водород может рождаться сразу не в атомарном, а в молекулярном состоянии. Именно это происходит при явлении кавитации или при фотосинтезе.

Рис. 118. Шести лучевые кластеры молекул воды, полученные
японскими учёными и методы их разрушения
Если в обычных условиях молекулы воды объединяются в ассоциации, называемые кластерами, то при переходе в парообразное состояние энергия связи между кластерами приближается к нулю, и у нас появляется возможность рассчитать энергию связи между молекулами в кластере при температуре 20 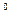 С. Для этого используем энергию парообразования 2595,2 кДж/кг. Переведем эту энергию в электрон-вольты в расчете на одну молекулу (рис. 118).
С. Для этого используем энергию парообразования 2595,2 кДж/кг. Переведем эту энергию в электрон-вольты в расчете на одну молекулу (рис. 118).
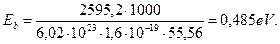 (233)
(233)
Этот результат близок к энергии связи (0,54 eV) электрона атома водорода в момент пребывания его на пятом энергетическом уровне (табл. 7) и свидетельствует о том, что у протона этого атома большая часть магнитных силовых линий идет на связь с электроном, а меньшая часть свободна и может быть задействована на связь с протоном атома водорода соседней молекулы воды (рис. 118, а).
Имеется также возможность рассчитать энергию, затрачиваемую на нагрев одной молекулы воды на один градус. Известно, что при нагревании одного литра воды от 20 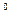 С до 100
С до 100 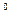 С затрачивается 335,2 кДж энергии. В расчете на одну молекулу это составит
С затрачивается 335,2 кДж энергии. В расчете на одну молекулу это составит
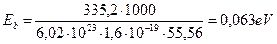 . (234)
. (234)
Это - величина энергии, на которую изменится энергия связи молекул воды в кластерах, если нагреть её от 20 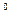 С до 100
С до 100  С. Разделив 0,063 eV на 80, получим величину, на которую изменяется энергия связи между молекулами воды в кластерах при нагревании её на один градус. Она оказывается равной 0,00078 eV. Эта энергия соответствует фотонам реликтового диапазона (табл. 2).
С. Разделив 0,063 eV на 80, получим величину, на которую изменяется энергия связи между молекулами воды в кластерах при нагревании её на один градус. Она оказывается равной 0,00078 eV. Эта энергия соответствует фотонам реликтового диапазона (табл. 2).
Таким образом, минимальная энергия фотонов, поглощаемых электронами молекулы воды при нагревании, соответствует энергиям фотонов реликтового диапазона, что служит дополнительным косвенным доказательством того, что этот диапазон является границей существования единичных фотонов.
На рис. 118, а показан линейный кластер из 2-х молекул воды. Энергия связи между протонами атомов водорода в этом кластере равна 0,485 eV (233) при температуре 20 град. Цельсия. При нагревании на один градус эта энергия связи уменьшается на 0,00078 eV. Минимальная величина, на которую может измениться эта энергия связи, равна энергии 0,000022 eV поглощаемого фотона с максимальной длиной волны 0,056м. Из этого следует, что минимальный градиент изменения температуры воды близок к 0,000022/0,00078=0,03 град. С .
Теперь появляется возможность уточнить номер энергетического уровня, на котором находятся электроны атомов водорода в молекуле воды. Для этого переведем энергию (286 кДж) синтеза одного моля воды в электрон-вольты
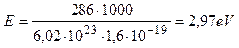 . (235)
. (235)
В расчете на одну связь имеем 2,97/2=1,485 eV. Это близко к энергии связи 1,51 eV электрона атома водорода, соответствующей пребыванию его на третьем энергетическом уровне. Из этого следует, что электроны атомов водорода и кислорода в молекуле воды находятся при обычной температуре (1,48/2=0,74eV) между четвертыми и пятыми энергетическими уровнями.
При переходе из газообразного в жидкое состояние атом кислорода (рис. 106, b) в молекуле воды должен уменьшить свой объём. Это произойдет, если кольцевые электроны атома кислорода опустятся на более низкие энергетические уровни (ближе к ядру). При этом каждый из 6-ти кольцевых электронов излучит фотон с энергией 1,18 eV (рис. 117). Это больше энергии (0,74 eV) связи с ядром осевых электронов и указывает на то, что кольцевые электроны расположены ближе к ядру, чем осевые.
Изложенное выше, проясняет причину взрыва при соединении водорода с кислородом (рис. 106) и образования молекулы воды. Одновременный переход шести кольцевых электронов каждого атома кислорода в рождающихся молекулах воды на более низкие энергетические уровни сопровождается одновременным излучением фотонов, которые и генерируют явление взрыва, так как их размеры на 5-7 порядков больше размеров электронов, излучающих фотоны.
Если представить себе кластер из двух молекул воды, имеющих формы шаров с диаметрами около 100 метров, то протоны, расположенные на поверхности этих шаров и связывающие их в кластер, имеют миллиметровые размеры. Малейшее, даже механическое, воздействие разрушит эту систему, создавая условия для текучести молекул воды.
Если бы кластеры образовывались электрон - электронными связями, то они бы имели уже метровые размеры на поверхности стометровых молекул.
На рис. 118, b) показан один вариант начала формирования шести лучевого кластера молекул воды. К шести кольцевым электронам атома кислорода в молекуле воды присоединяются протоны атомов водорода других молекул воды. Свободные концы образовавшихся шести лучей могут завершаться осевыми протонами (Р) атомов водорода в молекулах воды (рис. 118, b) или осевыми электронами (е) атомов кислорода (рис. 118, b).
Наличие на концах шести лучей протонов или электронов со свободными магнитными полюсами обеспечивает присоединение к ним других молекул воды или ионов 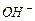 и
и 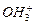 (рис. 118, b). Таким образом, обеспечивается формирование и рост шести лучевых кластеров молекул воды.
(рис. 118, b). Таким образом, обеспечивается формирование и рост шести лучевых кластеров молекул воды.
Приведенные интервалы изменения энергий связи между молекулами и ионами 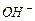 и
и 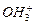 в шести лучевых кластерах и объясняют многообразие архитектоник этих формирований (рис. 118). Когда играет ритмичная классическая музыка, то она оказывает ритмичное возбуждающее действие на кольцевые электроны молекул азота и кислорода воздуха и те, излучая при этом воздействии фотоны с упорядоченными энергиями, способствуют формированию шести лучевых кластеров (рис. 118, с) молекул воды и её ионов
в шести лучевых кластерах и объясняют многообразие архитектоник этих формирований (рис. 118). Когда играет ритмичная классическая музыка, то она оказывает ритмичное возбуждающее действие на кольцевые электроны молекул азота и кислорода воздуха и те, излучая при этом воздействии фотоны с упорядоченными энергиями, способствуют формированию шести лучевых кластеров (рис. 118, с) молекул воды и её ионов 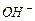 и
и 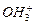 .
.
Успокоенный мозг и тело молящегося человека также излучают фотоны с упорядоченными энергиями, и это тоже приводит к формированию шести лучевых кластеров (рис. 118, d). Сотовый телефон излучает мощные импульсы фотонов с различными энергиями, которые сразу разрушают связи между молекулами кластера и он разрушается (рис. 118, e). Аналогичный результат получается при исполнении джазовой музыки. Её сумбурные, резкоменяющиеся звуки, передаются молекулам воздуха и те излучают фотоны с разным диапазоном энергий. При поглощении их электронами кластеров воды энергии связи между молекулами кластера могут уменьшаться до нуля. В результате кластер разрушается (рис. 118, e).
В одном кубическом метре содержится 1000х0,09=90 гр. водорода. Энергосодержание одного грамма молекулярного водорода равно 142 кДж. Энергосодержание одного кубического метра водорода оказывается таким 142х90=12780 кДж. Получаемая энергия 12780 кДж эквивалентна (12780/3600)=3,55 кВтч. Если удастся добиться меньших затрат энергии на получение одного кубического метра водорода, чем 3,55 кВтч, то он станет конкурентно-способным энергоносителем.
Дата добавления: 2016-06-22; просмотров: 6424;











