Структура молекулы воды и её ионов
Вода – наиболее распространенное химическое соединение. Разнообразие свойств, которые может проявлять вода скрыты в различиях структуры молекулы воды. Полученная нами информация позволяет приступить к раскрытию и анализу структурных особенностей молекулы воды.
Мы уже отметили, что связи между атомами в молекуле формируют поверхностные электроны, которые мы называем еще и валентными. Валентные электроны атомов, образующих молекулу, могут вступать в связь друг с другом или с протонами ядер, если ячейка ядра, где расположен протон, оказывается свободной. Это свойственно атому водорода.
Часть модели молекулы воды изображаются так, что угол между атомами водорода составляет 105 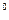 . Если считать, что он соответствует реальности, то с учетом модели ядра атома кислорода (рис. 106, а), модель молекулы воды будет такой, как показано на рис. 109. Эта модель дает основание считать, что электростатические силы отталкивания, действующие между первым (e1, P1) и вторым (e2, P2) атомами водорода, формируют угол 105
. Если считать, что он соответствует реальности, то с учетом модели ядра атома кислорода (рис. 106, а), модель молекулы воды будет такой, как показано на рис. 109. Эта модель дает основание считать, что электростатические силы отталкивания, действующие между первым (e1, P1) и вторым (e2, P2) атомами водорода, формируют угол 105 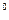 . Он образуется, видимо, у кластеров молекул воды, когда она замерзает и превращается в лёд.
. Он образуется, видимо, у кластеров молекул воды, когда она замерзает и превращается в лёд.
На рис. 110 показана структура молекулы воды, следующая из структур ядер атомов кислорода и водорода. Два электрона 1 и 2 атома кислорода расположены на оси атома, а шесть остальных – по кругу, перпендикулярному оси. Можно предположить, что суммарное электростатическое поле шести электронов, расположенных по кругу (назовем их кольцевыми электронами), удаляет первый и второй осевые электроны на большее расстояние от ядра атома, чем то расстояние от ядра атома, на котором распложены кольцевые электроны.
Поэтому осевые электроны атома кислорода являются его главными валентными электронами. Именно к этим электронам и присоединяются электроны атомов водорода, и образуется молекула воды (рис. 110).
Символами 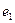 и
и 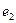 обозначены электроны атомов водорода, и символами
обозначены электроны атомов водорода, и символами 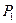 и
и 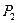 - протоны атомов водорода. Напомним, что номера электронам мы присваиваем в соответствии с последовательностью увеличения их потенциалов ионизации. Первым номером мы обозначили электрон атома кислорода, имеющий наименьший потенциал ионизации
- протоны атомов водорода. Напомним, что номера электронам мы присваиваем в соответствии с последовательностью увеличения их потенциалов ионизации. Первым номером мы обозначили электрон атома кислорода, имеющий наименьший потенциал ионизации 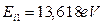 . Номером 2 мы обозначили второй электрон атома кислорода, имеющий потенциал ионизации
. Номером 2 мы обозначили второй электрон атома кислорода, имеющий потенциал ионизации 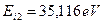 .
.
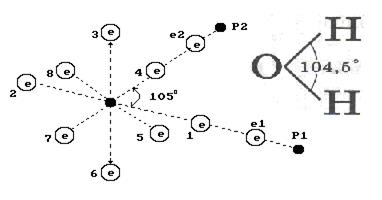
Рис. 109. Структура молекулы воды с углом 105  между атомами водорода
между атомами водорода
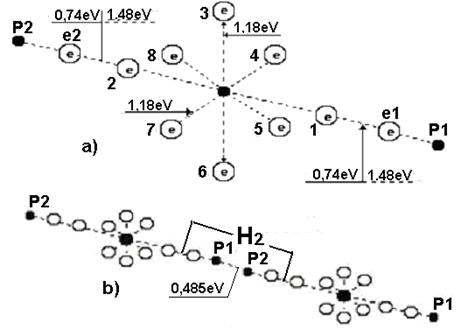
Рис. 110. Схема первой (заряженной) модели молекулы воды:
a) линейная схема 1,2,3,4,5,6,7,8 - номера электронов атома
кислорода;  - ядра атомов водорода (протоны);
- ядра атомов водорода (протоны); 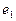 и
и 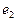 - номера электронов атомов водорода
- номера электронов атомов водорода
Обратим внимание на то, что осевые протоны ядра атома кислорода (рис. 106, а) отделены друг от друга кольцевыми и осевыми нейтронами. Поэтому при удалении из атома кислорода одного осевого электрона освободившиеся силовые линии магнитного поля осевого протона перераспределяются в цепочке протон - нейтрон-нейтрон - протон так, что напряженность магнитного поля свободного осевого протона ослабнет, а напряженность магнитного поля второго осевого протона, взаимодействующего со вторым электроном, усилится, и энергия его ионизации увеличится до 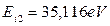 .
.
Описанное явление присуще, по-видимому, всем ядрам. Этот процесс назван процессом насыщения. Иначе нарушается равенство между электростатическими силами, сближающими электроны с протонами, и магнитными силами, ограничивающими это сближение в случаях, когда часть электронов покидает атом.
Структура атома водорода (рис. 86) показывает, что если этот атом соединится с первым осевым электроном атома кислорода своим единственным электроном, то протон окажется на поверхности молекулы и образует зону с положительным зарядом, который будет генерироваться протоном атома водорода. Аналогичную зону сформирует и протон второго атома водорода, который соединяется со вторым осевым электроном атома кислорода (рис. 110). Отрицательно заряженную зону сформируют электроны атома кислорода, расположенные по кольцу вокруг оси атома кислорода.
Поскольку при охлаждении электроны излучают фотоны и приближаются к ядру атома, то шесть кольцевых электронов атома кислорода в молекуле воды (рис. 110), приближаясь к ядру атома, своим статическим полем удаляют осевые электроны от ядра. В этом случае расстояние между атомами водорода, расположенными на оси молекулы воды, увеличиваются. За счет этого увеличивается длина связи с соседними молекулами воды при её замерзании. С учетом этого мы отдаем предпочтение модели молекулы воды, показанной на рис. 110, и в дальнейшем будем использовать только эту модель. Анализ изменения свойств воды с использованием модели, показанной на рис. 105, оставляем другим исследователям.
Обратим внимание на то, что кластеры воды формируются, прежде всего, протон - протонными связями, когда две её молекулы соединяются соосно. Если учесть, что размер протона на три порядка меньше размера электрона, то протон – протонная связь легче разрушается при механическом воздействии на такой кластер. Второй вариант образования кластера – соединение осевого протона с кольцевым электроном. Это – протон – электронная связь. Её прочность тоже меньше прочности электрон - электронной связи, которую имеют молекулы азота и кислорода. Эти факты и проясняют текучесть воды.
Молекулы воды формируют кластеры различных форм. При определённых условиях и определённой температуре (в зимних облаках) шесть молекул воды присоединяются своими протонами атомов водорода к кольцевым электронам другой молекулы воды или атома кислорода. В результате образуется шести лучевая структура, которая с увеличением размера и усложнением формирует ажурную шести лучевую структуру – снежинку (рис. 118, с). Этот естественный процесс реализуется при строго определённых энергиях связи валентных электронов, которые зависят от энергий поглощаемых и излучаемых фотонов.
Известны экспериментальные факты, когда вода, облучаемая мелодией спокойной классической музыки, формирует симметричные шести лучевые структуры (рис. 118, c). Такие же структуры формируются при облучении воды спокойным молитвенным голосом (рис. 118, d). , при котором тело молящегося излучает такие фотоны, которые необходимы для формирования связей симметричных структур. Не случайно поэтому, что такая вода, как это уже доказано, обладает лечебными свойствами.
Экспериментально установлено, что джазовая музыка и импульсы сигналов мобильных телефонов разрушают симметричные кластеры воды (рис. 118, е). Это обусловлено тем, что такая музыка инициирует окружающие предметы излучать фотоны с хаотически меняющимися энергиями. Поглощая такие фотоны, валентные электроны формируют безсимметричные кластеры. Конечно, это веское доказательство вредного влияния джазовой музыки на здоровье человека, ведь большая часть массы его тела – вода.
Новая теория ставит перед нами такой вопрос: сколько же электронов в молекуле воды? Всегда ли первый и второй электроны атома кислорода остаются в своих ячейках при приближении к ним электронов атомов водорода? У нас нет пока однозначного ответа на этот вопрос, и мы склонны полагать, что реализуются все возможные варианты. В одних случаях первый и второй (осевые) электроны атома кислорода отсутствуют в молекуле воды и их места занимают электроны атомов водорода. Но не исключено и присутствие этих электронов в молекуле воды, так как валентные электроны атомов, вступающих в связь, могут соединяться не только с протонами соседнего атома, но и с его валентными электронами. С учетом этого структура молекулы воды может отличаться количеством электронов в ней, и возникает необходимость дать названия этим структурам.
Структуру молекулы воды с полным набором электронов назовем первой моделью (рис. 110). Существуют возможности формирования молекулы воды не с десятью, а с восемью электронами (рис. 111). Такую модель назовем второй.
Главные различия между первой (рис. 110) и второй (рис. 111) моделями молекулы воды заключаются в том, что в ячейках первого и второго (осевых) электронов атома кислорода первой модели молекулы воды находятся по два спаренных электрона, а во второй модели молекулы воды в этих ячейках располагаются по одному электрону и поэтому у нас есть основания назвать их не спаренные электроны (рис. 111).
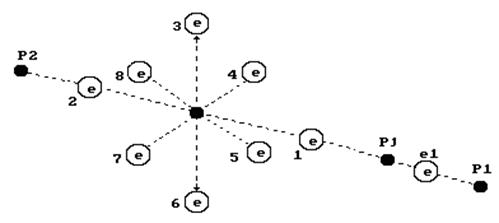
Рис. 111. Схема второй (разряженной) модели молекулы воды
Когда спаренные электроны расположены только на одном конце оси атома кислорода, то такую модель назовем третьей (рис. 112, справа).
Если гипотеза о разном количестве электронов в молекулах воды подтвердится, то этот факт окажется решающим при получении избыточной энергии при электролизе воды. Он определит причину положительных и отрицательных результатов многочисленных экспериментов, которые ставились для проверки факта существования дополнительной энергии при электролизе воды и явлениях её кавитации.
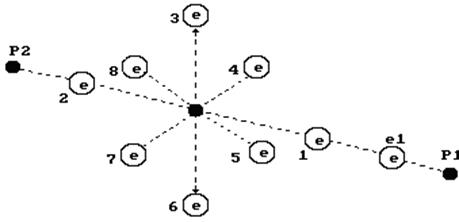
Рис. 112. Схема третьей (полу заряженной) модели молекулы воды
Если вода содержит больше заряженных молекул, то эксперимент даст положительный результат. При большем количестве разряженных молекул результат будет отрицательный. Примерные расчеты показывают наличие разницы в массе одного литра заряженной и разряженной воды. Её можно зафиксировать современными измерительными приборами.
Факт разного количества электронов в молекуле воды имеет экспериментальное подтверждение. Оказалось, что при многократном проходе раствора щёлочи через плазмоэлектролитический реактор в растворе накапливается значительный электрический потенциал.
Отметим ещё один экспериментальный факт. Известно, что при вращении воды в трубе её тёплые молекулы оказываются у внутренней стенке трубы, холодные – ближе к оси трубы. Причина та же, что и при аналогичном распределении молекул воздуха. При охлаждении молекулы воды излучают фотоны и их масса становится меньше массы тёплых молекул. В результате центробежная сила инерции прижимает теплые, более тяжёлые, молекулы к внутренней стенке трубы, а холодные, с меньшей массой, оказываются вблизи её оси.
Дальше мы приведём результаты лабораторных исследований, из которых явно следует, что в ближайшем будущем вода – второй после Солнца источник тепловой энергии и основной энергоноситель будущей экологически чистой водородной энергетики.
Известно, что вода может обладать щелочными или кислотными свойствами. Щелочные свойства формируются за счет увеличенного содержания в воде гидроксила  . На рис. 113 представлена схема модели гидроксила. На одном конце оси гидроксила расположен электрон атома кислорода, а другой завершается протоном атома водорода. Таким образом, гидроксил – идеальное звено электрической цепи. Под действием приложенного напряжения эти ионы формируют линейные кластеры с положительным и отрицательным знаками на концах. В результате импульс напряжения передаётся вдоль этого кластера. Конечно, ток не течёт вдоль кластера. Он формируется благодаря тому, что ион гидроксила, расположенный на конце кластера у анода отдаёт ему свой электрон, а протон атома водорода иона, расположенного у катода, получает электрон из катода.
. На рис. 113 представлена схема модели гидроксила. На одном конце оси гидроксила расположен электрон атома кислорода, а другой завершается протоном атома водорода. Таким образом, гидроксил – идеальное звено электрической цепи. Под действием приложенного напряжения эти ионы формируют линейные кластеры с положительным и отрицательным знаками на концах. В результате импульс напряжения передаётся вдоль этого кластера. Конечно, ток не течёт вдоль кластера. Он формируется благодаря тому, что ион гидроксила, расположенный на конце кластера у анода отдаёт ему свой электрон, а протон атома водорода иона, расположенного у катода, получает электрон из катода.
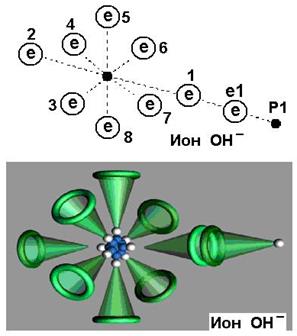
Рис. 113. Схема модели гидроксила 
Конечно, при этом идут сложные реакции. У анода образуются, а потом распадаются молекулы перекиси водорода, а у катода формируются молекулы водорода. Детали этих процессов мы опишем позднее, при анализе процесса электролиза воды.
Кислотные свойства воды формируются, как принято сейчас считать, свободными протонами 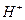 , но мы с этой идеей не соглашаемся потому, что протон - слишком активное образование и поэтому не может существовать в воде в свободном состоянии. Кислотные свойства воды формируются увеличенным содержанием в ней положительно заряженных ионов гидроксония
, но мы с этой идеей не соглашаемся потому, что протон - слишком активное образование и поэтому не может существовать в воде в свободном состоянии. Кислотные свойства воды формируются увеличенным содержанием в ней положительно заряженных ионов гидроксония 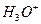 (рис. 114).
(рис. 114).
Во всех моделях молекулы воды (рис. 110-113) кольцевые электроны атома кислорода остаются свободными, формируя зону отрицательного потенциала на ее поверхности. Величины третьего и четвертого потенциалов ионизации атома кислорода указывают на то, что кольцевые электроны распложены ближе к ядру атома кислорода, чем осевые, поэтому большая часть их электрических и магнитных силовых линий включена в связь с ядром атома кислорода, и они менее активны, чем первый и второй осевые электроны (рис. 113).
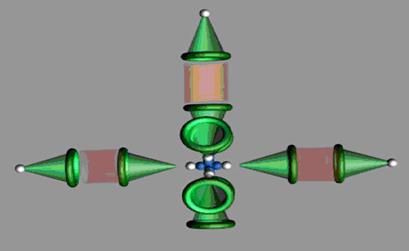
Рис. 114. Схема иона гидроксония 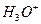
Чтобы один из кольцевых электронов вступил в связь с протоном или электроном соседнего атома, ему необходимо подняться в своей ячейке и удалиться от ядра атома кислорода. Для реализации такого процесса ему необходимо поглотить фотон из окружающей среды. Если это произойдет, то он удалится от ядра, приблизится к поверхности атома, и лишь тогда появятся условия для взаимодействия между электрическими и магнитными полями обоих электронов. Если один из кольцевых электронов атома кислорода соединится с электроном атома водорода, то образуется ион гидроксония 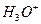 , который и сформирует кислотные свойства воды (рис. 114).
, который и сформирует кислотные свойства воды (рис. 114).
При таком развитии событий на поверхности молекулы воды появятся три зоны с положительным потенциалом и она станет положительно заряженным ионом 
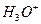 , который называют гидроксонием (рис. 114). Таким образом, кислотные свойства раствора определяет не протон (положительный ион
, который называют гидроксонием (рис. 114). Таким образом, кислотные свойства раствора определяет не протон (положительный ион 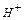 ), а положительный ион гидроксония
), а положительный ион гидроксония 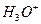 . Процесс удаления электрона от ядра атома сопровождается поглощением фотонов из окружающей среды, поэтому процесс образования иона гидроксония эндо-термический.
. Процесс удаления электрона от ядра атома сопровождается поглощением фотонов из окружающей среды, поэтому процесс образования иона гидроксония эндо-термический.
Перекись водорода 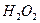 , также образуется из воды. В её структуре два атома кислорода
, также образуется из воды. В её структуре два атома кислорода  и два атома водорода
и два атома водорода  (рис. 115).
(рис. 115).
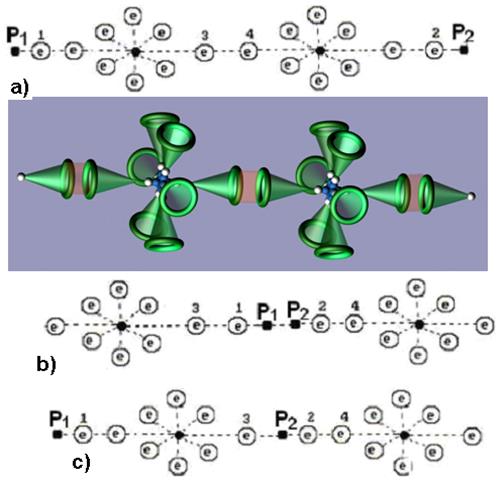
Рис. 115. Схемы молекул перекиси водорода 
Чистая перекись водорода – бесцветная сиропообразная жидкость, обладающая сильными окислительными свойствами. Эта особенность перекиси водорода позволяет установить комбинации атомов кислорода и водорода, которые может иметь эта жидкость.
Варианты комбинации атомов водорода и кислорода представлены на рис. 115. Структура, представленная на рис. 111, а, эквивалентна молекуле воды (рис. 114), так как концы оси молекулы завершаются протонами ( 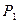 и
и 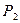 ) атомов водорода. Такая структура не может быть активной, так как активность определяют электроны. Поэтому есть основания полагать, что молекула перекиси водорода имеет структуру, показанную на рис. 115, b. У этой структуры на концах оси электроны, так же как и у молекулы кислорода.
) атомов водорода. Такая структура не может быть активной, так как активность определяют электроны. Поэтому есть основания полагать, что молекула перекиси водорода имеет структуру, показанную на рис. 115, b. У этой структуры на концах оси электроны, так же как и у молекулы кислорода.
Структура, показанная на рис. 115, с, эквивалентна структуре молекулы параводорода (рис. 88, с), который тоже не обладает свойствами активности при обычной температуре.
Дата добавления: 2016-06-22; просмотров: 5822;











