Структура атома и молекулы кислорода
Атом кислорода – восьмой элемент периодической таблицы химических элементов, расположенный в её шестой группе. Структура его ядра показана на рис. 106, а. Симметричность ядра должна передаваться атому. На рис. 106, b и d представлены схемы атома кислорода, следующие из структуры его ядра (рис. 106, а), а на рис. 106, с – схема молекулы кислорода.
Атом кислорода значительно активнее атома азота, так как у него два осевых активных электрона 1 и 2 (рис. 106, b). Это обусловлено тем, что шесть кольцевых электронов, расположенных в плоскости, перпендикулярной осевой линии, своим суммарным электрическим полем удаляют электроны 1 и 2 от ядра на большее расстояние, формируя условия для большей их активности при взаимодействии с электронами соседних атомов.
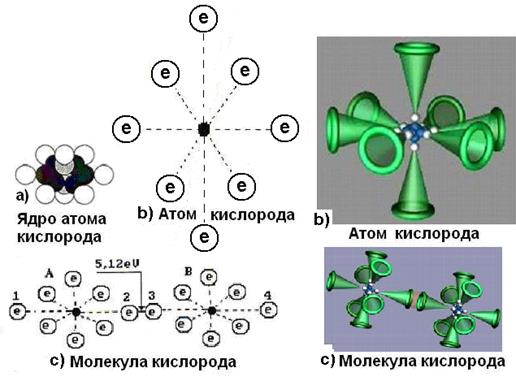
Рис. 106. Схемы ядра, атома и молекулы кислорода
Структура молекулы кислорода показана на рис. 106, с. Она образуется путем соединения разноименных магнитных полюсов осевых электронов двух атомов кислорода. Молекула кислорода, в отличии от молекулы азота, имеет значительную химическую активность, которая обеспечивается осевыми электронами 1 и 2 наиболее удаленными от ядер атомов (рис. 106, b и с).
7.10. Структуры молекул 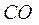 и
и 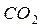
Окись углерода или угарный газ 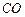 -продукт неполного сгорания углеродосодержащих веществ. Это ядовитый газ без цвета и запаха. Его ядовитые свойства обусловлены несимметричностью молекулы
-продукт неполного сгорания углеродосодержащих веществ. Это ядовитый газ без цвета и запаха. Его ядовитые свойства обусловлены несимметричностью молекулы 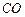 и неравномерностью распределения энергий связи электронов с протонами ядер атомов. Наибольшую активность имеет осевой электрон 2’ атома кислорода (рис. 107).
и неравномерностью распределения энергий связи электронов с протонами ядер атомов. Наибольшую активность имеет осевой электрон 2’ атома кислорода (рис. 107).
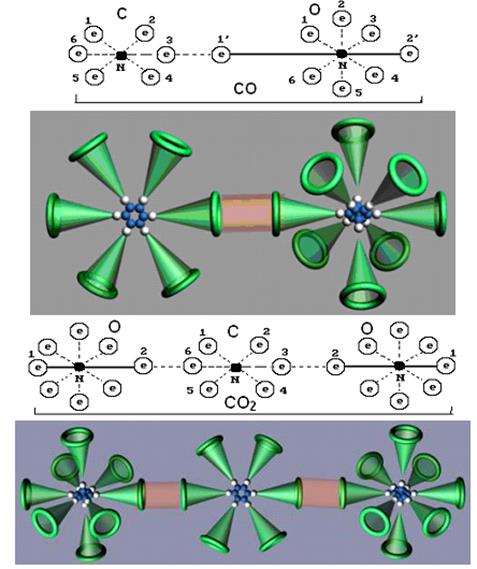
Рис. 107. Схемы молекул 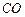 и
и 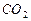
Углекислый газ или двуокись углерода 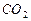 (рис. 107, b)–бесцветное газообразное вещество в полтора раза тяжелее воздуха. Сжижается при комнатной температуре под давлением 69 атм., а при выпуске из баллона испаряется.
(рис. 107, b)–бесцветное газообразное вещество в полтора раза тяжелее воздуха. Сжижается при комнатной температуре под давлением 69 атм., а при выпуске из баллона испаряется. 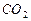 не поддерживает ни горения, ни дыхания. Причина этого – предельная симметричность молекулы (рис. 107, b), выравнивающая энергии связи электронов с протонами ядер и снижающая их химическую активность.
не поддерживает ни горения, ни дыхания. Причина этого – предельная симметричность молекулы (рис. 107, b), выравнивающая энергии связи электронов с протонами ядер и снижающая их химическую активность.
Дата добавления: 2016-06-22; просмотров: 4451;











