Расчет спектра первого электрона атома бора
Атом бора имеетпять электронов. Электрон, который имеет наименьшую энергию ионизации 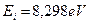 , назовем первым. Он имеет следующий ряд энергий возбуждения [А.П. Стриганов]: 4,96; 5,93; 6,79; 6,82; 7,44; 7,46; 7,75; 7,88; 7,92; 7,95; 8,02; 8,03; 8,08; 8,09; 8,13; 8,16; 8,18; 8,20; 8,22; 8,23; 8,24; 8,25; 8,26; 8,27 eV. Достаточно длинный ряд. Обратим внимание на подчеркнутые близкие значения энергий. Это, видимо, дуплеты и триплеты, то есть расщепленные линии. Поэтому расчет должен давать одно из подчеркнутых значений или их средние величины. Посмотрим так это или нет? Разность энергий
, назовем первым. Он имеет следующий ряд энергий возбуждения [А.П. Стриганов]: 4,96; 5,93; 6,79; 6,82; 7,44; 7,46; 7,75; 7,88; 7,92; 7,95; 8,02; 8,03; 8,08; 8,09; 8,13; 8,16; 8,18; 8,20; 8,22; 8,23; 8,24; 8,25; 8,26; 8,27 eV. Достаточно длинный ряд. Обратим внимание на подчеркнутые близкие значения энергий. Это, видимо, дуплеты и триплеты, то есть расщепленные линии. Поэтому расчет должен давать одно из подчеркнутых значений или их средние величины. Посмотрим так это или нет? Разность энергий 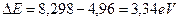 . Энергия связи этого электрона с ядром атома, соответствующая первому фиктивному энергетическому уровню, определится по формуле
. Энергия связи этого электрона с ядром атома, соответствующая первому фиктивному энергетическому уровню, определится по формуле 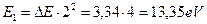 . Подставляя
. Подставляя 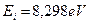 и
и 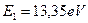 в формулы (178) и (180), найдем (табл. 21).
в формулы (178) и (180), найдем (табл. 21).
Анализируя приведенный экспериментальный ряд энергий возбуждения и результаты его расчета, представленные в таблице 21, видим хорошую сходимость теоретических и экспериментальных данных.
Таблица 21. Спектр первого электрона атома бора
| Знач. | n | ||||||
 (эксп.) (эксп.)
| eV | 4,96 | 6,82 | 7,46 | 7,75 | 7,92 | 8,02 |
 (теор.) (теор.)
| eV | 4,96 | 6,81 | 7,46 | 7,76 | 7,93 | 8,02 |
| Знач. | n | ||||||
 (эксп.) (эксп.)
| eV | 8,09 | 8,13 | 8,16 | 8,18 | 8,20 | 8,22 |
 (теор.) (теор.)
| eV | 8,09 | 8,13 | 8,16 | 8,18 | 8,20 | 8,22 |
| Знач. | n | ||||||
 (эксп.) (эксп.)
| eV | 8,23 | 8,24 | 8,25 | 8,25 | 8,26 | ... |
 (теор.) (теор.)
| eV | 8,23 | 8,24 | 8,25 | 8,25 | 8,26 | ... |
Далее мы не будем пытаться рассчитывать спектры всех электронов, всех атомов, а приведем лишь расчеты спектров тех атомов и тех валентных электронов, которые мы использовали при анализе результатов своих теоретических и экспериментальных исследований.
Дата добавления: 2016-06-22; просмотров: 2412;











