Окислительно-восстановительные потенциалы
Возьмем для примера гальванический элемент, электродами которого являются две платиновые пластинки, опущенные в растворы  и
и  . В этом элементе по проводнику, соединяющему электроды, будет идти электрический ток в результате реакции:
. В этом элементе по проводнику, соединяющему электроды, будет идти электрический ток в результате реакции:
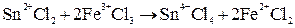
Схема элемента для этой реакции:
анод 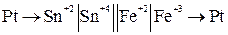 катод
катод
 окисление восстановление
окисление восстановление
На аноде происходит отдача электронов, то есть окисление

На катоде – присоединение электронов, то есть восстановление

В таком гальваническом элементе исходные и полученные продукты реакции образуют окислительно-восстановительную пару 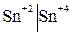 и
и  .
.
Разность потенциалов на границе этих двух форм: восстановитель – окисленная форма 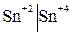 или окислитель – восстановленная форма
или окислитель – восстановленная форма  , называется окислительно-восстановительным потенциалом.
, называется окислительно-восстановительным потенциалом.
Обычно пользуются величинами потенциалов, измеренными относительно стандартного водородного электрода, потенциал которого принят равным нулю.
Потенциалы, измеренные при стандартных условиях, называются стандартными окислительно-восстановительными потенциалами.
Чем больше ЕО.В., тем сильнее окислительные свойства иона или вещества-окислителя в данной паре.
Пример. Сравним окислительно-восстановительные свойства галогенов.
С увеличением порядкового номера уменьшаются окислительные, и увеличиваются восстановительные свойства. Это подтверждается окислительно-восстановительными потенциалами:
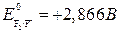
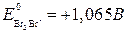
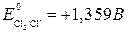
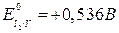 (может быть и окислителем и восстановителем)
(может быть и окислителем и восстановителем)
Окислительно-восстановительный потенциал вычисляется по уравнению Нернста:
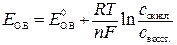 ,
,
где 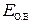 – окислительно-восстановительный потенциал данной пары;
– окислительно-восстановительный потенциал данной пары;
 – концентрация или активность окисленной формы;
– концентрация или активность окисленной формы;
 – концентрация или активность восстановленной формы;
– концентрация или активность восстановленной формы;
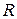 – газовая постоянная;
– газовая постоянная;
Т – абсолютная температура;
п – число электронов, отданных или полученных при превращении восстановленной формы в окисленную;
 – число Фарадея;
– число Фарадея;
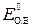 – стандартный окислительно-восстановительный потенциал.
– стандартный окислительно-восстановительный потенциал.
Если подставить 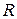 и Т и перейти к десятичному логарифму, то уравнение Нернста примет вид:
и Т и перейти к десятичному логарифму, то уравнение Нернста примет вид:
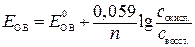 .
.
Дата добавления: 2020-03-21; просмотров: 532;











