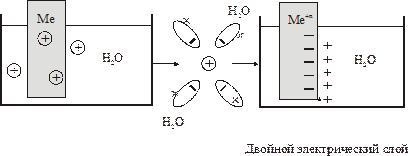
Двойной электрический слой. Электродные потенциалы.
Особенность электрохимических реакций – это ОВР, протекающие в пограничной области металл (проводник)/раствор, т.е. на поверхности электродов (анода и катода), с участием электронов.
При погружении в воду или раствор соли металлической пластинки, то под действием полярных молекул воды, металл посылает в раствор электроны,
по схеме:
Мео – nē ® Меn+
Меn+ + nē ® Мео
С течением времени устанавливается динамическое равновесие:
Meо + m H2O  Me(H2O)mn+ + nē
Me(H2O)mn+ + nē
Или упрощенно Мео  Меn++ nē
Меn++ nē
Выделяют два случая (для активных и малоактивных металлов):
1. активные металлы при погружении в растворы своих солей, даже незначительных концентраций, легко посылают ионы в раствор.
на примере цинковой пластинки

| Znо – 2ē ® Zn2+ электрод/р-р электролита Электроны остаются на пластинке и заряжают ее «–», ионы цинка перешедшие в раствор заряжают жидкость «+». На границе раздела металлической пластинки (электрода) с раствором электролита, возникает двойной электрический слой толщиной 10–7 см с определенной разностью потенциалов. |
2. малоактивные металлы
на примере медной пластинки
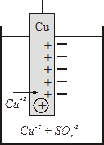
| Сu2+ + 2ē → Cuо р-р электролита/ электрод из растворов легче переходят на пластинку (при этом происходит их восстановление) заряжая ее положительно, из-за избытка анионов раствор вокруг пластинки заряжается отрицательно. Образуется двойной электрический слой. |
Таким образом, разность потенциалов электрод/электролит называется электродным потенциалом (Е, j [В]). Он зависит от природы металла, концентрации его ионов в растворе и температуры.
Если концентрация ионов равна 1 моль/л при температуре 25 оС, то электродный потенциал обозначают jо и называют стандартным электродным потенциалом.
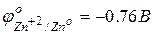
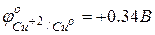 в числителе – окисленная форма, в знаменателе – восстановленная форма, знак соответствует возникающему на металле заряду в двойном слое.
в числителе – окисленная форма, в знаменателе – восстановленная форма, знак соответствует возникающему на металле заряду в двойном слое.
Абсолютное значение электродного потенциала определить невозможно, однако можно определить разность электродных потенциалов исследуемого металла и так называемого водородного электрода, электродный потенциал которого в стандартных условиях принят равным нулю.
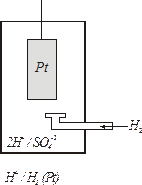
Водородный электрод устроен следующим образом:
Платиновая пластинка помещается в 1 М раствор серной кислоты. Снизу в раствор подается водород, который насыщает платину. При этом на её поверхности устанавливается равновесие
Н2 – 2ē ⇄ 2Н+
Ввиду химической пассивности платины в данных условиях возникший электродный потенциал относится к водороду и обозначается
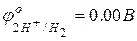
Для определения значения потенциала металла собирают гальванический элемент из водородного электрода и испытуемого металла, погруженного в 1М раствор его соли. Разница электродных потенциалов испытуемого металла и водородного электрода принимается за электродный потенциал испытуемого металла.
Таблица стандартных электродных потенциалов.
Для всех металлов стандартные электродные потенциалы найдены и составляют ряд стандартных электродных потенциалов (ряд активности, ряд напряжений – устаревш. Справедлив только для водных растворов!). На его основании составлена таблица – «Стандартные электродные потенциалы металлов».
Впервые она была составлена в 1886 году выдающимся химиком Н.Н. Бекетовым.
Таблица стандартных электродных потенциалов характеризует химическую активность металлов. В таблице выделяют три группы металлов (деление условное, зависящие от концентрации ионов металла в растворе):
1. очень активные металлы – от лития до алюминия;
2. металлы средней активности от цинка до водорода;
3. неактивные металлы, металлы стоящие за водородом.
Таблица обладает следующими свойствами:
1. чем меньше электродный потенциал металла, тем больше его восстановительная способность и тем активнее металл (восстановительная активность растет, ¯окислительная активность ионов уменьшается);
2. металлы, имеющие отрицательный электродный потенциал и стоящие в ряду напряжений до водорода, вытесняют его из разбавленных растворов кислот, кроме азотной кислоты;
3. каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые в ряду напряжений стоят после него.
Например, железо вытесняет медь из раствора хлорида меди:
Fe + CuCl2 = FeCl2 +Cu,
а медь вытесняет ртуть из раствора нитрата ртути:
Cu + Hg(NO3)2 = Hg + Cu(NO3)2
Для условий, отличных от стандартных (по концентрации раствора), величина электродного потенциала рассчитывается по формуле Нернста:
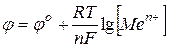
| где | jо – стандартный электродный потенциал (В);
F – постоянная Фарадея (96500 Кл/экв);
R – универсальная газовая постоянная (8,314 Дж/моль);
T – фактическая температура (298 К);
n – число электронов, принимающих участие в процессе;
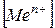 – концентрация (активность) ионов металла в растворе (моль/л) – концентрация (активность) ионов металла в растворе (моль/л)
|
Подставляя численные значения всех постоянных, получают более простой вид уравнения Нернста:
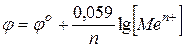
Пример. Цинковая пластинка погружена в 0,01 раствор её соли.
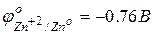
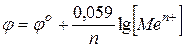
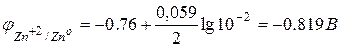
3. Гальванический элемент – является химическим источником тока.
Гальванический элемент –это устройство, предназначенное для преобразования энергии окислительно-восстановительной реакции в электрическую энергию. Простейшим ГЭ является элемент Даниэля-Якоби, состоящий из цинкового и медного электродов, погруженных в растворы своих солей – сульфатов цинка и меди.
Растворы разделены полупроницаемой мембраной.
Элемент Даниэля-Якоби
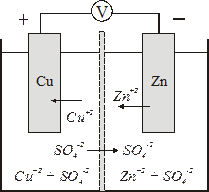
| На цинковом электроде окисляется цинк Zn – 2ē ® Zn2+ (анодный процесс), электроны окисленных атомов по внешней цепи поступают на медный электрод, где ионы меди восстанавливаются из раствора Сu2+ + 2ē → Cu (катодный процесс). |
Одновременно часть ионов SO42- для выравнивания отрицательных потенциалов катодного и анодного пространств переходит через пористую перегородку в сосуд с раствором сульфата цинка.
Данные процессы будут идти до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк или не выделится вся медь. Суммарное уравнение процесса
Zn + CuSO4 = ZnSO4 +Cu
Электроды называются в соответствии с происходящими на них процессами. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Электрическая схема рассмотренного гальванического элемента записывается следующим образом:
| (–) А, Zn | Zn SO4 || Cu SO4 | Cu, К (+) А (–) Zn – 2ē ® Zn2+ К (+) Сu2+ + 2ē → Cu | ||
| Zn + Сu2+ ® Zn2+ + Cu Zn + CuSO4 = ZnSO4 +Cu |
Одинарная вертикальная черта означает границу раздела между электродом и электролитом, а двойная черта означает границу между проводниками второго рода, т.е. электролитами. Проводниками 1 рода считают металлы, в которых заряд перемещается за счет движения электронов, а проводниками 2 рода – электролиты (в этом случае носителями заряда являются ионы).
На каждом электроде возникает собственный электродный потенциал. Разность этих потенциалов называется электродвижущей силой или ЭДС
ЭДС = 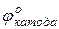 –
– 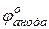
Всегда является положительной величиной, т. к. определяется вычитанием более отрицательного потенциала, из более положительного.
Так, для элемента Даниэля-Якоби ЭДС = 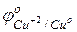 –
– 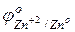 = 0,34 + 0,76 = 1,1В
= 0,34 + 0,76 = 1,1В
Элемент Вольта – элемент, в котором электроды находятся в общем растворе электролита.
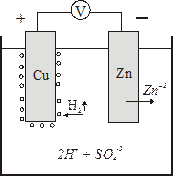
| (–) А, Zn | H2SO4| Cu, К (+) А (–) Zn – 2ē ® Zn2+ К (+) 2Н++ 2ē ® Н2 |
| Zn + 2Н+® Zn2+ + Н2 Zn + H2SO4 ® ZnSO4+ Н2 |
Наиболее активный цинк посылает свои ионы в раствор, а освободившиеся электроны по внешней цепи перемещаются к меди, где и восстанавливаются имеющиеся в растворе положительные ионы.
В таком элементе на катоде, происходит восстановление ионов электролита (водорода), а с самим катодом (медной пластинкой) ничего не происходит.
То обстоятельство, что образующийся продукт – газ, порождает побочное явление.
Поверхность электрода (медной пластинки) покрывается пузырьками водорода и катодный потенциал становится более отрицательным. Поэтому и ЭДС, т.е. разность потенциалов гальванического элемента уменьшается.
Падение ЭДС ГЭ в следствии изменения химической природы поверхности электрода называется поляризацией. Различают – газовую, концентрационную и химическую поляризации.
Для устранения газовой поляризации применяют деполяризаторы – сильные окислители (кислород, оксид серебра, оксид марганца IV), связывающие образующийся водород в негазообразные продукты. Концентрационную поляризацию можно уменьшить перемешиванием электролита, но целиком ее устранить нельзя.
ЭЛЕКТРОЛИЗ
Электролизом называется окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита.
Окисление и восстановление происходит на электродах, пространственно разделенных друг от друга. При пропускании постоянного электрического тока через расплав или раствор электролита его ионы движутся к противоположно заряженным электродам на которых происходит их разрядка. Электрод, на котором при электролизе происходит восстановление положительно заряженных ионов – катионов, является катодом, а электрод, на котором осуществляется процесс окисления анионов – анодом. При электролизе катод (–) заряжен отрицательно, а анод (+) положительно.
Ионы на электродах разряжаются, при этом, и при электролизе, и при гальванических процессах на катоде происходит восстановление, а на аноде – окисление.
На характер и течение электродных процессов при электролизе большое влияние оказывает состав электролита, растворитель, материал анода и режим электролиза (напряжение, плотность тока, температура и др.).
Различают электролиз расплавленных электролитов и их растворов. В последнем случае в процессах участвуют молекулы и ионы воды.
Дата добавления: 2020-12-11; просмотров: 990;











