Электрохимические процессы
Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Электрохимические процессы можно разделить на 2 основные группы:
1) процессы превращения химической энергии в электрическую (в гальванических элементах);
2) процессы превращения электрической энергии в химическую (электролиз).
Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником. Ионным проводником (проводником 2-го рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники, имеющие электронную проводимость (проводники 1-го рода) и находящиеся в контакте с ионным проводником. Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы. Рассмотрим вначале общие закономерности электрохимических процессов. К ним относятся законы Фарадея, термодинамика и кинетика электрохимических процессов.
Законы Фарадея. В 1833 г. английский ученый Фарадей открыл законы, определяющие зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химические превращения на электроде.
С учетом современной терминологии законы Фарадея можно сформулировать в следующем виде:
1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
При превращении одного моля эквивалентов вещества на электроде через него проходит 96484, или округленно 96500 Кл (А∙с). Эта величина называется постоянная Фарадея F. Постоянную Фарадея можно рассчитать исходя из того, что один моль эквивалентов вещества несет 6,022∙1023 элементарных зарядов (постоянная Авогадро), а элементарный заряд равен 1,602∙10-19 Кл. Отсюда F = 6,022∙1023∙1,602∙10-19 = 96484 или ≈ 96500 Кл/(моль∙экв).
Таким образом, зная количество вещества, испытавшего превращения на электроде, можно рассчитать теоретическое количество электричества, которое должно пройти через электрохимическую ячейку. Например, если в результате реакции

на электроде выделилось 63,54 г меди, то теоретическое количество электричества определяется из соотношения
96500 Кл (26,8 А∙ч) – 31,77 г Cu (масса моля эквивалентов)
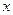 « - 63,54 г « Cu
« - 63,54 г « Cu
Отсюда следует, что через электрод теоретически должно пройти количество электричества
 .
.
Или, если в результате реакции

на электроде выделилось при нормальных условиях 5,6 л водорода, то теоретическое количество электричества можно определить из соотношения
96500 Кл – 1 г 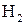 (11,2 л
(11,2 л 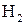 – объем моля эквивалентов)
– объем моля эквивалентов)
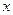 « 5,6 л
« 5,6 л 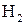
Соответственно
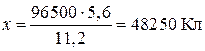 .
.
На законах Фарадея основаны расчеты электрохимических установок, а на их базе созданы счетчики количества электричества (кулонометры, интеграторы тока) и другие устройства.
Понятие об электродном потенциале. Рассмотрим процессы, протекающие при погружении металла в раствор собственных ионов. В узлах кристаллической решетки металла расположены ионы, находящиеся в равновесии со свободными электронами:
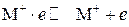
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной является реакция поверхностных ионов металла, находящихся в узлах решетки, с полярными молекулами воды, ориентированными у поверхности электрода. В результате взаимодействия происходит окисление металла, и его гидротированные ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле:
 .
.
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл – раствор возникает двойной электрический слой.
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода. По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует окислению металла. Наряду с этой реакцией протекает обратная реакция – восстановление ионов металла до атомов:
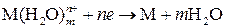 .
.
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала скорость прямого процесса будет равна скорости обратного процесса, устанавливается равновесие:
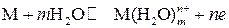 .
.
Для упрощения гидратационную воду обычно в уравнение реакции не включают, и оно записывается в виде
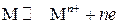 .
.
Равновесие имеет динамический характер, процессы при равновесии идут с одинаковой скоростью в прямом и обратном направлениях. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется электродным потенциалом. Абсолютные значения электродных потенциалов экспериментально определить невозможно. Однако можно определить разность электродных потенциалов. Поэтому для характеристики процессов пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимают равным нулю.
Дата добавления: 2020-03-21; просмотров: 582;











