Гальванический элемент Даниэля-Якоби
Рассмотрим систему, в которой 2 электрода находятся в растворах собственных ионов. Примером может служить гальванический элемент Даниэля-Якоби (рис. 6.1.).
Он состоит из медной пластины, погруженной в раствор 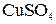 и цинковой пластины, погруженной в раствор и цинковой пластины, погруженной в раствор 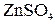 . .
| 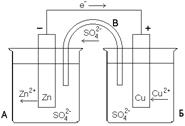 Рис. 6.1. Схема гальванического элемента Даниэля-Якоби
Рис. 6.1. Схема гальванического элемента Даниэля-Якоби
|
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие
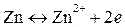 .
.
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие
 ,
,
поэтому возникает электродный потенциал меди. Потенциал цинкового электрода имеет более отрицательное значение, поэтому при замыкании внешней цепи электроны будут переходить от Zn и Cu.
В результате равновесие на цинковом электроде сместится вправо, а на медном – влево (т. е. происходят самопроизвольные процессы растворения Zn на цинковом электроде и выделение Cu на медном электроде). Данные процессы будут происходить до тех пор, пока не выравняются потенциалы электродов или не растворится весь цинк (или не выделится на медном электроде вся медь).
Итак, при работе г. э. Даниэля-Якоби протекают процессы:
1) реакция окисления цинка
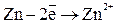
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления называют анодами;
2) реакция восстановления ионов меди
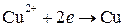
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
3) движение электронов во внешней цепи от Zn к Cu.
4) движение ионов в растворе: анионов ( 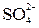 ) к аноду, катионов (
) к аноду, катионов ( 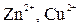 ) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получаем:
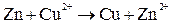
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т. е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода – двумя чертами. Схема элемента Даниэля-Якоби, например, записывается в виде
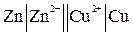
Электродвижущая сила гальванического элемента. Электрическая работа равна произведению разности потенциалов электродов на количество электричества. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента:
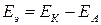
ЭДС гальванического элемента связана с химической (энергией Гиббса) и электрической энергиями:
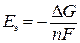 ,
,
где 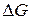 – энергия Гиббса;
– энергия Гиббса;  – постоянная Фарадея = 96500 Кл/моль;
– постоянная Фарадея = 96500 Кл/моль; 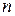 – заряд ионов, количество электронов.
– заряд ионов, количество электронов.
Если концентрации (активности) веществ, участвующих в реакции = 1, получаем 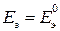 . Для газообразных веществ активности заменяют относительными парциальными давлениями. Стандартной называется ЭДС элемента, если парциальные относительные давления исходных веществ и продуктов реакции равны единице или активности исходных веществ и продуктов реакции равны единице.
. Для газообразных веществ активности заменяют относительными парциальными давлениями. Стандартной называется ЭДС элемента, если парциальные относительные давления исходных веществ и продуктов реакции равны единице или активности исходных веществ и продуктов реакции равны единице.
Рассчитаем стандартную ЭДС элемента Даниэля-Якоби:
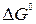 для этой реакции = - 212,3 кДж/моль = - 212,3 кВт
для этой реакции = - 212,3 кДж/моль = - 212,3 кВт 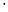 с/моль
с/моль
Стандартный водородный электрод. ЭДС гальванического элемента равна разности равновесных потенциалов положительного электрода и отрицательного электрода.
Если потенциал одного из электродов принять равным нулю, то потенциал второго электрода будет равен ЭДС элемента.
За нуль принят потенциал стандартного водородного электрода (рис. 6.2.).
В раствор 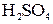 погружают платиновую пластинку, покрытую губчатой платиной. Через раствор пропускают чистый водород (активность ионов Н+ = 1, р = 100 кПа ( погружают платиновую пластинку, покрытую губчатой платиной. Через раствор пропускают чистый водород (активность ионов Н+ = 1, р = 100 кПа (  ), Т = 298 К). Губчатая ), Т = 298 К). Губчатая  адсорбирует в большом количестве водород.
Адсорбированный Н2 взаимодействует с молекулами Н2О переходит в раствор в виде ионов, оставляя в платине электроны. При этом платина заряжается отрицательно, а раствор положительно. Возникает скачок потенциала между платиной и раствором. Одновременно идет обратный процесс восстановления ионов Н+ с образованием молекулы Н2. адсорбирует в большом количестве водород.
Адсорбированный Н2 взаимодействует с молекулами Н2О переходит в раствор в виде ионов, оставляя в платине электроны. При этом платина заряжается отрицательно, а раствор положительно. Возникает скачок потенциала между платиной и раствором. Одновременно идет обратный процесс восстановления ионов Н+ с образованием молекулы Н2.
| 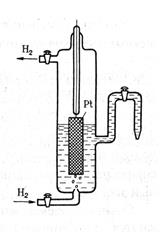 Рис.6.2. Схема водородного электрода
Рис.6.2. Схема водородного электрода
|
Между адсорбированным водородом и ионами водорода устанавливается равновесие
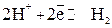 .
.
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод.
Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид:
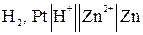 ,
,
а схема элемента для измерения потенциала медного электрода –
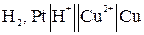 .
.
ЭДС элемента равна разности потенциалов правого и левого электродов. А так как потенциал левого электрода условно принимается равным нулю, то ЭДС измеряемого элемента будет равна потенциалу правого электрода.
Например, для водородно-цинкового элемента ЭДС равна
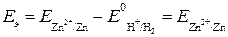
По отношению к стандартному водородному электроду выражают потенциалы всех других электродов.
В общем виде схема гальванического элемента для измерения потенциалов металла:
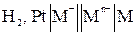
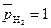 ,
, 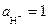 .
.
Токообразующей в этом элементе будет реакция:
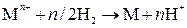 ,
,
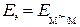 ,
,
так как по условию 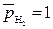 ,
, 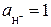 , то
, то
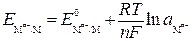 – уравнение Нернста,
– уравнение Нернста,
где Е0 – стандартный потенциал металла; 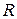 – газовая постоянная – 8,315 Дж/К
– газовая постоянная – 8,315 Дж/К 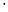 моль; Т – абсолютная температура; п – валентность катиона;
моль; Т – абсолютная температура; п – валентность катиона;  – число Фарадея – 96500 кулонов;
– число Фарадея – 96500 кулонов; 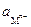 – активность металла.
– активность металла.
Если в приведенном уравнении заменить константы 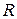 и
и  их численными значениями, а натуральный логарифм десятичным (переводной коэффициент 2,303), то, применительно к температуре 250 С (Т = 298 К), оно примет следующий вид:
их численными значениями, а натуральный логарифм десятичным (переводной коэффициент 2,303), то, применительно к температуре 250 С (Т = 298 К), оно примет следующий вид:
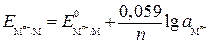 ,
,
где 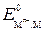 – стандартный потенциал металлического электрода.
– стандартный потенциал металлического электрода.
При 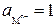 ,
, 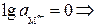
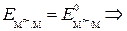 стандартным потенциалом металлического электрода называют потенциал этого электрода в растворе собственных ионов с их активностью, равной 1.
стандартным потенциалом металлического электрода называют потенциал этого электрода в растворе собственных ионов с их активностью, равной 1.
Ряд напряжений металлов. Значения электродных стандартных потенциалов металлов служат мерой их активности. Электродные потенциалы малоактивных металлов ( 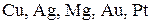 ) выражаются положительными значениями, а более активных металлов – отрицательными.
) выражаются положительными значениями, а более активных металлов – отрицательными.
Особенности ряда напряжений:
1. Ряд напряжений позволяет судить о химической активности металлов лишь в реакциях, идущих в водной среде.
2. Все металлы, стоящие до Н2, вытесняют его из разбавленных растворов кислот.
3. Каждый из металлов этого ряда вытесняет все следующие за ними металлы из растворов их солей.
4. В ряду напряжений слева направо убывает восстановительная способность атомов металлов и возрастает окислительная способность ионов металлов.
Дата добавления: 2020-03-21; просмотров: 1034;











