Электролиз растворов солей
Пример 1. Электролиз водного раствора  .
.
При электролизе водных растворов солей нужно учитывать: 1) все ионы в водном растворе гидратированы; 2) в водном растворе помимо самого вещества присутствуют молекулы воды и ионы Н+ и ОН-.
Электролит  состоит из следующих частиц, способных участвовать в электродных процессах:
состоит из следующих частиц, способных участвовать в электродных процессах: 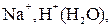
 и
и 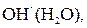 а также воды. Концентрация ионов
а также воды. Концентрация ионов 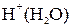 и
и  мала, так как обусловлена слабой диссоциацией молекул
мала, так как обусловлена слабой диссоциацией молекул 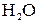 .
.
Восстанавливаться на катоде могут только молекулы 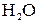 :
:
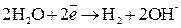
Восстановление катионов  невозможно из-за электроотрицательного потенциала (
невозможно из-за электроотрицательного потенциала (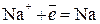
 В).
В).
Из-за возможных процессов окисления:
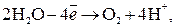
 В,
В,
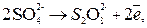
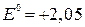 В.
В.
на аноде будет протекать реакция, которой отвечает меньший потенциал, то есть окисление воды с выделением О2.
Итак, при электролизе водного раствора  на катоде выделяется Н2, а на аноде – О2.
на катоде выделяется Н2, а на аноде – О2.
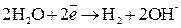 ,
,
 .
.
причем электролит около катода становится щелочным, а около анода – кислым.
Суммарный процесс электролиза
 .
.
Подобное изменение среды в электролите у катода и анода может быть использовано для получения щелочей и кислот, если обеспечить неперемешиваемость растворов у обоих электродов.
Аналогично протекает электролиз водных растворов солей, образованных щелочными и щелочно-земельными металлами и кислородсодержащей кислотой ( 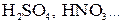 ).
).
Пример 2. Электролиз водного раствора 
На катоде будут восстанавливаться катионы меди:
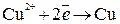 ;
;
на аноде будет кислород в результате реакции окисления воды:
 .
.
Суммарное уравнение электролиза:
 .
.
Пример 3. Электролиз раствора  .
.
На катоде при электролизе этого раствора выделяется водород
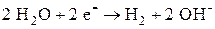 ,
,
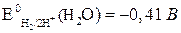 .
.
На аноде выделяется хлор по реакции

Именно таким путем – электролизом насыщенного раствора хлорида натрия – в промышленности получают хлор.
Суммарное уравнение электролиза раствора 
Дата добавления: 2020-03-21; просмотров: 549;











