И направление самопроизвольных процессов
Изменение энтропии однозначно определяет направление и предел самопроизвольного протекания процесса лишь для наиболее простых систем – изолированных: если в результате расчета окажется, что DS > 0, процесс пойдет самопроизвольно, при DS = 0 – состояние равновесия, если DS < 0, процесс самопроизвольно протекать не будет.
На практике приходится иметь дело преимущественно с системами, взаимодействующими с окружающей средой. В качестве критерия оценки направления самопроизвольных процессов в таких системах используются термодинамические потенциалы.
Термодинамическим потенциалом называют функцию состояния, убыль которой в обратимо протекающем процессе при постоянстве определенных параметров равна максимальной полезной работе.
Наибольшее значение имеют два основных термодинамических потенциала: энергия Гельмгольца F (T, V) и энергия Гиббса G (T, p). В скобках указаны параметры, функциями которых являются термодинамические потенциалы.
Чтобы получить представление о термодинамических потенциалах, воспользуемся объединенным математическим выражением первого и второго законов термодинамики.
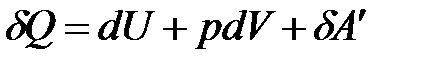 .
.
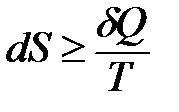 или
или 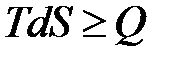 .
.
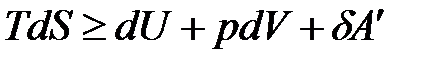 ,
,
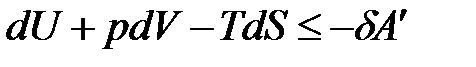 . (1.23)
. (1.23)
Рассмотрим соответствующие процессы.
И з о б а р н о – и з о т е р м и ч е с к и й п р о ц е с с (p, T = const).
Уравнение (1.23) запишется
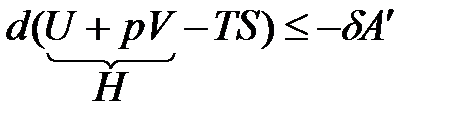 ,
,
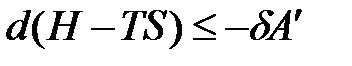 ,
,
где H – TS = G –свободная энергия Гиббса. При p, T = const изменение энергии Гиббса связано с выполнением полезной работы:
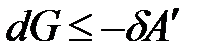 .
.
В обратимо протекающем процессе 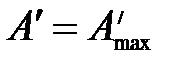 . Тогда
. Тогда
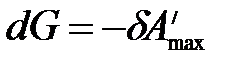 ,
,
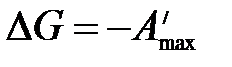 .
.
Таким образом, свободная энергия Гиббса является изобарно-изотермическим потенциалом, так как ее уменьшение характеризует максимальную работу этого процесса.
Если единственным видом работы является работа расширения (сжатия), т.е. 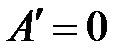 , то в необратимом, а, следовательно, самопроизвольно протекающем процессе
, то в необратимом, а, следовательно, самопроизвольно протекающем процессе
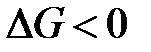 . (1.24)
. (1.24)
И з о х о р н о – и з о т е р м и ч е с к и й п р о ц е с с (V, T = const).
Уравнение (1.23) примет вид
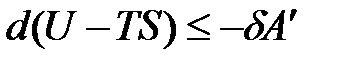 ,
,
где U – TS = F – свободная энергия Гельмгольца. При V, T = const изменение энергии Гельмгольца связано с выполнением полезной работы:
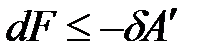 .
.
В обратимо протекающем процессе
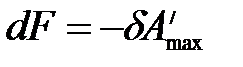 ,
,
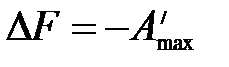 .
.
Таким образом, свободная энергия Гельмгольца является изохорно-изотермическим потенциалом.
Если 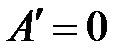 , то в самопроизвольно протекающем процессе
, то в самопроизвольно протекающем процессе
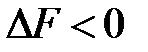 . (1.25)
. (1.25)
Неравенства (1.24), (1.25) являются условием самопроизвольного протекания процесса при постоянстве соответствующих параметров: самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения (рис. 1.7.).
| Направление процесса |
| G |
| Gmin |
| а) б) Рис. 1.7. Изменение свободной энергии в самопроизвольном процессе, протекающем при:а) р, Т = const; б) V, Т = const |
| Направление процесса |
| F |
| Fmin |
Процессы, которые сопровождаются увеличением термодинамических потенциалов, протекают лишь при совершении работы извне над системой.
Изменение соответствующего термодинамического потенциала в ходе какого-либо процесса, протекающего при температуре Т, вычисляют по уравнению Гиббса-Гельмгольца:
– для изобарно-изотермического процесса
DG = DH – TDS, (1.26)
– для изохорно-изотермического процесса
DF = DU – TDS. (1.27)
Основываясь на уравнении Гиббса-Гельмгольца (1.26), (1.27), можно оценить вклад энтальпийного и энтропийного факторов в величину ΔG (или ΔF) и сделать некоторые обобщающие заключения о возможности самопроизвольного протекания химических процессов.
1. Экзотермические реакции, ΔH < 0.
Если ΔS > 0, то ΔG всегда отрицательно; экзотермические реакции, сопровождающиеся увеличением энтропии, всегда протекают самопроизвольно.
Если ΔS < 0, реакция будет идти самопроизвольно при DH > TDS (низкие температуры).
2. Эндотермические реакции, ΔH > 0.
Если ΔS > 0, процесс будет самопроизвольным при DH < TDS (высокие температуры).
Если ΔS < 0, то ΔG всегда положительно; самопроизвольное протекание эндотермических реакций, сопровождающихся уменьшением энтропии, невозможно.
Термодинамические потенциалы могут играть роль характеристических функций. Это значит, что с помощью их производных можно выразить свойства системы, необходимые для ее характеристики.
Изобарно-изотермический потенциал является функцией двух параметров – давления и температуры, т.е.
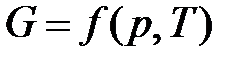 .
.
Запишем dG в виде суммы частных производных
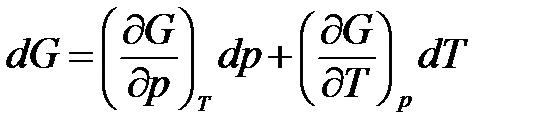 . (1.28)
. (1.28)
Учитывая, что
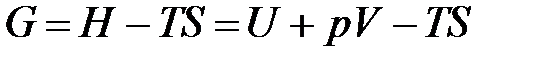 ,
,
получаем:
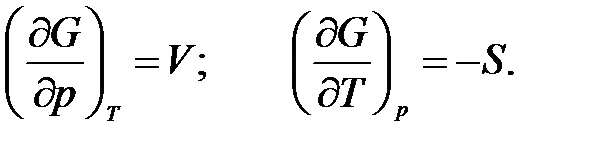
Изохорно-изотермический потенциал является функцией объема и температуры, т.е.
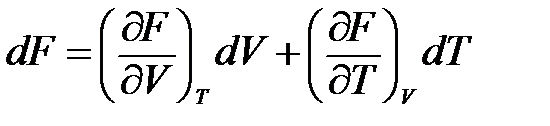 . (1.29)
. (1.29)
По определению
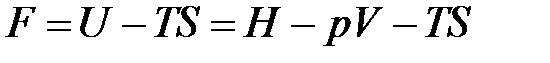 ,
,
откуда следует, что
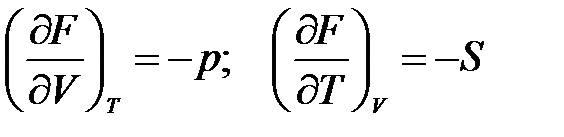 .
.
Легко установить связь между DG и DF. Вычитая из уравнения (1.26) уравнение (1.27), и учитывая, что DU = DН – DnRT, получим:
DG = DF + DnRT.
Разберем физический смысл изобарно-изотермического и изохорно-изотермического потенциалов.
DG = DH – TDS, DF = DU – TDS;
DH = DG + TDS, DU = DF + TDS,
где DH иDU – изменение полной энергии в системе при р = const и V = const соответственно; DG иDF – энергия, которая связана с производством полезной работы; TDS – энергия, которая перешла в энергию хаотичного (теплового) движения частиц, вследствие чего она уже не может перейти в работу.
Поэтому DG иDF называют еще свободной энергией, а TDS – связанной энергией.
Т а б л и ц а
Дата добавления: 2016-06-22; просмотров: 2660;











