Химический потенциал
Свободная энергия системы (энергия Гиббса G и энергия Гельмгольца F) зависит от внешних условий:
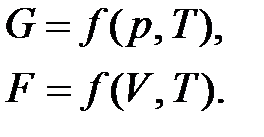
Эта зависимость является полной для простейших систем, состоящих из одного компонента.
Термодинамическая система может состоять как из одного, так и из нескольких компонентов. Очевидно, что величина свободной энергии многокомпонентной системы будет зависеть как от внешних условий (Т, р, или V), так и от природы и количества веществ, составляющих систему, т. е. свободная энергия, как и любая термодинамическая функция, является экстенсивным свойством системы.В случае, если состав системы изменяется во времени (т.е. в системе протекает химическая реакция), необходимо учесть влияние изменения состава на величину свободной энергии системы.
Рассмотрим термодинамическую систему, состоящую из k компонентов. Пусть n1, n2, …, nk – число моль 1-го, 2-го, …, k-го компонентов. Тогда свободная энергия Гиббса является функцией следующих переменных:
G = f(p, T, n1, n2, …, nk)
Продифференцируем по всем переменным:
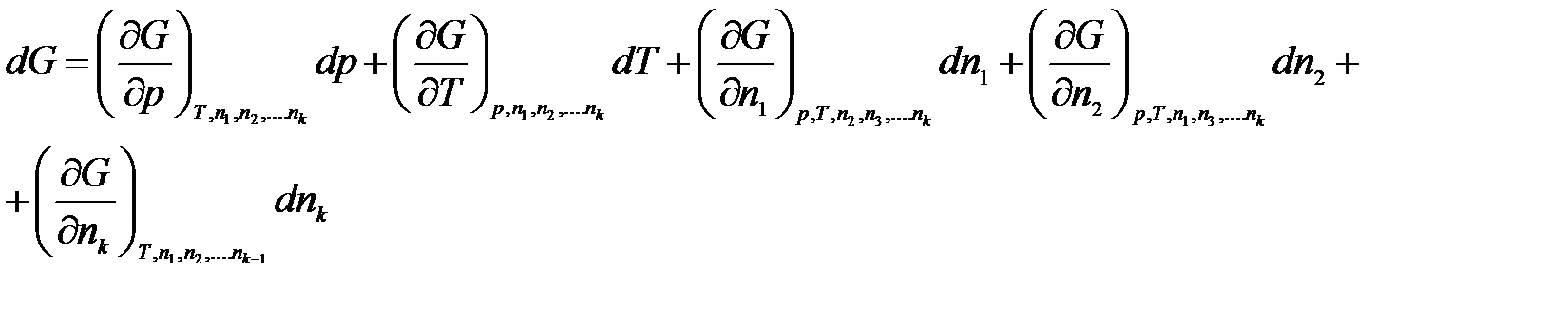 (2.1)
(2.1)
Введем обозначение:
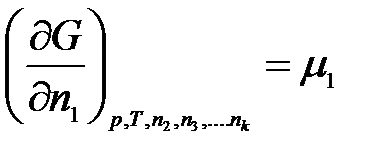
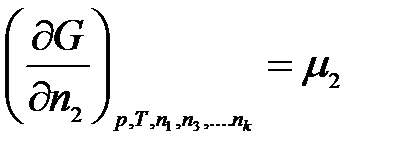
………………….
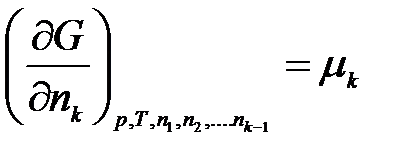 ,
,
где μ1, μ2, …, μk – химические потенциалы 1-го, 2-го, …, k-го компонентов соответственно.
В общем виде
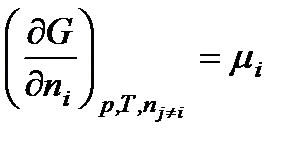 .
.
Аналогичное выражение получаем для свободной энергии Гельмгольца:
F = f(V, T, n1, n2, …, nk)
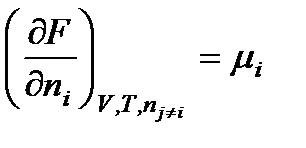 .
.
Таким образом, химический потенциал – это частная производная от свободной энергии по количеству моль i-го компонента при постоянстве соответствующих внешних параметрах и числе моль всех остальных компонентов. Таким образом, химический потенциал является парциальной мольной энергией Гиббса (при р, Т = const):
 .
.
Свободная энергия – это общее свойство системы, химический потенциал характеризует свойства отдельного компонента, входящего в систему. Химический потенциал является интенсивным свойством системы, т.к. не зависит от массы системы.
При р, Т = const уравнение (2.1) имеет вид:
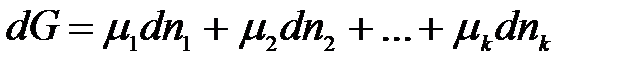 ;
;
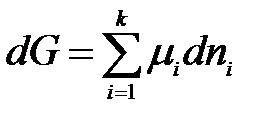 . (2.2)
. (2.2)
В этом случае изменение энергии Гиббса, то есть полезная работа системы, обусловлена только изменением состава системы в результате протекания химической реакции или вследствие обмена веществом между системой и окружающей средой.
Уравнение (2.2) выражает взаимосвязь между общим свойством системы и свойствами каждого ее компонента. Приняв, что химический потенциал является постоянной величиной, проинтегрируем уравнение (2.2):
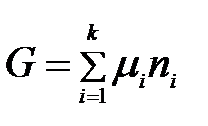 .
.
Константа интегрирования равна нулю, поскольку, если все ni = 0, энергия Гиббса также равна нулю.
Для индивидуального вещества
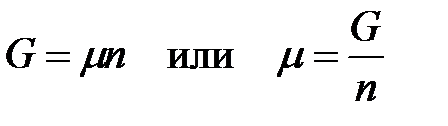 ,
,
т.е. химический потенциал индивидуального вещества равен мольной энергии Гиббса.
При равновесии dG = 0 и уравнение (2.1) принимает вид:
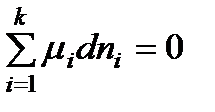 . (2.3)
. (2.3)
Полученное уравнение является общим условием равновесия в системе с переменным составом при р, Т = const.
Дата добавления: 2016-06-22; просмотров: 2869;











